CPV seu pé direito também na medicina
|
|
|
- Bernardo Barbosa Alcaide
- 6 Há anos
- Visualizações:
Transcrição
1 CPV seu pé direito também na medicina UNICAMP 2 a fase /janeiro/200 Química As questões dessa prova exploram matérias da Revista Pesquisa FAPESP (Fundação de Amparo à Pesquisa do Estado de São Paulo), uma publicação mensal disponível gratuitamente na rede mundial. Essa é uma importante fonte de informação para a sociedade em geral e particularmente útil para quem quer aprender e ensinar em todas as áreas do conhecimento. 0. Numa entrevista à Revista n 6, um astrofísico brasileiro conta que propôs, em um artigo científico, que uma estrela bastante velha e fria (6.000 K), da constelação de Centauro, tem um núcleo quase totalmente cristalizado. Esse núcleo seria constituído principalmente de carbono e a estrela estaria a caminho de se transformar em uma estrela de diamante, com a cristalização do carbono. a) O pesquisador relata ter identificado mais 42 estrelas com as mesmas características e afirma: Enquanto não termina o processo de cristalização do núcleo, as estrelas de diamante permanecem com a temperatura constante. No que diz respeito à temperatura, independentemente de seu valor absoluto, ele complementa essa afirmação fazendo uma analogia entre o processo que ocorre na estrela e a solidificação da água na Terra. Com base no conhecimento científico, você concorda com a analogia feita pelo pesquisador? Justifique. b) Ao final da reportagem afirma-se que: No diamante da estrela, apenas 0,0 Å separa os núcleos dos átomos do elemento que o compõem. Considerando-se que o raio atômico do carbono no diamante da Terra é de 0,77 Å, quanto valeria a relação numérica entre os volumes atômicos do carbono (Terra/estrela)? Mostre seu raciocínio. a) Sim, pois a solidificação da água também ocorre com temperatura constante durante todo processo. b) raio estrela = 0, 0 A = 0,005 A 2 raio Terra = 0,77 A 4 p raio Terra relação = 4 = (0,77 / 0,005) p raio estrela CPV Unicamp200 2a Fase 02. Na Revista n 46 descreve-se um sistema de descontaminação e reciclagem de lâmpadas fluorescentes que separa seus componentes (vidro, mercúrio, pó fosfórico e terminais de alumínio), tornando-os disponíveis como matérias-primas para reutilização em vários tipos de indústria. a) Num trecho da reportagem, a responsável pelo projeto afirma: Essa etapa (separação do mercúrio é realizada por um processo de sublimação do mercúrio, que depois é condensado à temperatura ambiente e armazenado para posterior comercialização. Considerando apenas esse trecho adaptado da reportagem, identifique as tranformações físicas que o mercúrio sofre e as equacione adequadamente. b) Em relação à recuperação do mercúrio, a pesquisadora afirma: O mínimo para comercialização é quilo, sendo que de cada mil lâmpadas só retiramos 8 gramas de mercúrio, em média. Segundo a literatura, há cerca de 2 mg desse metal em uma lâmpada de 40 W. No contexto dessas informações, discuta criticamente a eficiência do processo de recuperação do mercúrio, considerando que todas as lâmpadas recolhidas são de 40 W. a) ª transformação (sublimação): Hg(s) + calor Hg (g) 2ª transformação (condensação): Hg(g) Hg (l) + calor b) 000 lâmpadas g de Hg lâmpada ,008 g de Hg = 8 mg de Hg 2 mg de Hg % de eficiência 8 mg de Hg x x = 8% de eficiência O processo é pouco eficiente, pois apresenta baixo desempenho.
2 2 UNICAMP /0/200 CPV seu pé direito também na Medicina 0. Na Revista n 6 relatam-se alguns aspectos da pesquisa brasileira do etanol de segunda geração que visa à obtenção desse importante combustível a partir do bagaço e da palha da cana-de-açúcar. A obtenção do álcool pode se dar pela hidrólise desses materiais em meio ácido. Num dos trechos afirma-se: enquanto o ácido sulfúrico destrói parte do açúcar formado, o ácido clorídrico, mais eficiente, tem um problema ligado à corrosividade, exigindo ligas de metal de custos elevados. a) A destruição do açúcar, citada no texto, pode ser exemplificada pela reação da sacarose com ácido sulfúrico concentrado, representada simplificadamente pela equação química: C 2 H 22 O (s) + H 2 SO 4 ( ) 2 C(s) + n H 2 O (g) + H 2 SO 4.( n)h 2 O( ); DH<0 onde n<. Levando-se em conta o conhecimento químico e a equação química apresentada, que evidências experimentais poderiam sugerir que o exemplo dado é uma reação química? b) Um tipo de corrosão química do aço se deve à presença do íon cloreto. Diferenças na composição do aço podem levar a diferenças na resistência à corrosão; quanto maior o valor de PRE (Pitting Resistance Equivalent), mais resistente é o aço. Com base nos dados da tabela abaixo, que aço você escolheria para construir um reator para a obtenção de etanol do bagaço da cana por hidrólise com ácido clorídrico? Justifique. Dado: PRE = %Cr+, %Mo+6 %N Tipo de aço 04LN %Cr 9 %Mo 0 %N 0,2 SAF , , 904L 9 4 0, a) Pode-se perceber as seguintes evidências: efervescência (liberação de H 2 O(g)); liberação de calor (reação exotérmica); formação de sólido preto (C(s)). b) O aço deve ter grande resistência à corrosão, ou seja, o maior PRE possível. Utilizando-se a fórmula fornecida, tem-se: PRE do aço 04LN = 9 +, ,2 = 22,2 PRE do aço SAF2205 = 22 +, ,2 = 5, PRE do aço 444 = 8 +, , = 26,2 PRE do aço 904L = 9 +, , =,8 Portanto, o mais aconselhável seria o aço SAF Milagre, Milagre... É a imagem de uma santa na vidraça! Muitos comentários desse tipo foram veiculados na imprensa em Diante de tantas hipóteses e superstições para explicar a observação, a Revista n 79 traz uma reportagem onde se conclui: Aos poucos, portanto, a ciência desvenda os enigmas da natureza e, nesse caso, ensina que a Nossa Senhora das Vidraças não é um fenômeno do além. É apenas fruto do acaso... a) Do ponto de vista da Química, o texto afirma, em palavras, que um dos estágios da corrosão do vidro, em presença de água, pode ser representado simplificadamente pelo esquema abaixo: O Na + O Na + OH OH O H 2 O Si O Si O Si O Si O O O O O que ocorre com o valor de ph da água (aumenta, diminui ou permanece constante) após um contato prolongado com o vidro? Justifique sua resposta. b) Também se afirma no texto que se o vidro estiver exposto a um ambiente úmido e rico em CO 2, um resíduo sólido pode se depositar em sua superfície. Dê o nome do resíduo e a equação química da reação de formação do depósito. a) O ph aumenta devido ao consumo dos íons H + após reagirem com o vidro. b) Trata-se das substâncias carbonato de sódio e bicarbonato de sódio, cujas reações de formação seguem abaixo: 2 NaOH + CO 2 Na 2 CO + H 2 O NaOH + CO 2 NaHCO CPV Unicamp200 2a Fase
3 CPV seu pé direito também na Medicina UNICAMP /0/ Marcas Esmaecidas - Gel feito de látex natural é a mais recente promessa para combater rugas. Um teste preliminar realizado com 60 mulheres de idade próxima a 50 anos indicou uma redução de 80% das rugas na região da testa e dos olhos, após quase um mês de uso diário de um gel antirrugas feito de látex da seringueira. Esses dados são parte de uma reportagem sobre farmacologia, divulgada pela Revista n 57. a) O látex natural, a que se refere o texto, é uma dispersão coloidal de partículas de polímeros que, após coagulação, leva à formação da borracha natural. A partir da estrutura dos monômeros fornecidos no espaço de resposta, represente dois polímeros do látex, usando 4 monômeros em cada representação. b) Calcule a massa molar (g mol ) de um látex cuja cadeia polimérica, para efeito de cálculo, é constituída por unidades do monômero. a) b) unidade de C 5 H g 0000 unidades de C 5 H g 06. A Revista n 6 relata um debate entre pesquisadores no workshop Impactos Socioeconômicos, Ambientais e de Uso da Terra, sobre questões ambientais associadas à produção do etanol. A seguir, alguns trechos adaptados desse debate são transcritos: A cana colhida com queima (colheita manual) reduz o estoque de carbono no solo, mas a colhida sem queima (mecânica) aumenta o estoque de carbono, podendo fazer o solo reter até toneladas de carbono por hectare em três anos, afirma um pesquisador do Centro de Energia Nuclear na Agricultura (CENA-USP). Não temos encontrado grande benefício em deixar palha sobre o solo. Chegamos a ganhos mais modestos, de apenas 00 quilogramas de carbono por hectare ao longo dos 6 anos de acompanhamento de canaviais em Pernambuco tratados com e sem queima. É interessante observar que a quantidade de carbono estocado no solo depende do grau de degradação do solo; solos mais degradados retêm mais carbono que os mais bem conservados, comenta um pesquisador da Empresa Brasileira de Pesquisa Agropecuária (Embrapa). a) Levando-se em conta os trechos selecionados do debate, em que aspecto os resultados obtidos pelos pesquisadores concordam entre si e em que sentido eles discordam? Justifique b) Num outro trecho do debate, outro pesquisador conclui: Os cálculos de impacto e benefícios ambientais dependem de conhecimentos do impacto sobre o uso do solo, que não são claros. Levando-se em conta esses trechos citados, as questões ambientais atuais e o ciclo do carbono na Terra, depreende-se que a preocupação final nesse debate seria com o solo ou com a atmosfera? Explique. a) Os pesquisadores discordam quanto à quantidade de carbono retida pelo solo e concordam que a colheita sem queima favorece o estoque de carbono no solo. b) Com ambos, pois a degradação do solo diminui a produtividade agrícola e a retenção de carbono no solo reduz a poluição atmosférica (redução do efeito estufa devido à menor produção de CO 2 ). 07. Uma equipe do Instituto Nacional de Pesquisas Espaciais (INPE) propõe um sistema de captação de gás metano nos reservatórios de usinas hidrelétricas localizadas na bacia do rio Amazonas (essa proposta está esquematicamente representada na figura abaixo): O primeiro passo é a colocação de uma membrana () para impedir que as turbinas (2) das hidrelétricas suguem águas ricas em metano. Essa membrana seria fixada a bóias () na superfície e ancorada no fundo por pesos e, assim, a água que entraria nas turbinas viria de camadas superficiais de represa, com menor concentração de metano. Um sistema de dutos de captação (4) coletaria a água rica em metano no fundo da represa e a levaria para a extração do gás em um sistema (5) de vaporização. O metano poderia ser queimado em uma termelétrica (6), gerando energia limpa e redução de uma fonte do aquecimento global. Adaptado da Revista n 8. a) Considerando o texto e a figura abaixo, escreva o respectivo número em cada um dos círculos da figura, e explique por que a concentração de metano é maior na região sugerida pelos pesquisadores. b) O texto afirma que a queima do metano na termelétrica gera energia e leva a uma redução do aquecimento global. Nesse contexto, escreva a equação química da combustão do gás metano. Explique como essa combustão leva a uma redução do aquecimento global, tendo como base a equação química e o conhecimento químico. CPV UNICAMP200 2a fase
4 4 UNICAMP /0/200 CPV seu pé direito também na Medicina a) A concentração de metano é maior no fundo da represa, pois neste lugar há maior quantidade de matéria orgânica em decomposição. b) CH 4 + O 2 CO H 2 O A transformação do metano (CH 4 ) em gás carbônico leva a uma redução do aquecimento global, pois o metano é um gás que agrava o efeito estufa numa proporção muito maior que o gás carbônico (cerca de 20 vezes mais). 08. A Revista n o 60 traz um comentário sobre um ônibus montado no Brasil que tem como combustível o gás hidrogênio. Resumidamente, explica-se que no ônibus existem celas eletroquímicas formadas por um conjunto de placas (eletrodos) e uma membrana polimérica chamada membrana de troca de prótons. Em um tipo de eletrodo, o hidrogênio é quebrado (aspas nossas) e elétrons são liberados, gerando uma corrente elétrica em direção ao outro tipo de eletrodo, onde o gás oxigênio forma íons óxido. Os produtos que se originam nos dois diferentes eletrodos reagem para formar água. a) Considerando-se as informações do texto, escreva a equação química da semirreação de oxidação que ocorre nessa cela eletroquímica. b) Que massa de gás hidrogênio deve ser transformada na cela eletroquímica para que, no funcionamento do ônibus, haja uma liberação de 8,0 MJ? Dado: entalpia de formação da água = 242 kj mol. a) 2 H 2 H+ + e b) H O 2 H 2O DH = 242 kj mol 2 g (liberam) J x g (liberam) J x = 4 g CPV Unicamp200 2a Fase
5 CPV seu pé direito também na Medicina UNICAMP /0/ A Revista n o 62 apresenta uma pesquisa desenvolvida no Instituto de Pesquisas Energéticas e Nucleares (IPEN) sobre a produção de fios de irídio-92 para tratar tumores. Usados em uma ramificação da radioterapia chamada braquiterapia, esses fios são implantados no interior dos tumores e a radiação emitida destrói as células cancerígenas e não os tecidos sadios. O 92 Ir se transforma em 92 Pt por um decaimento radioativo e esse decaimento em função do tempo é ilustrado na figura abaixo. 0. Um estudo divulgado na Revista n o 56 mostra as possíveis consequências da ingestão de pastas dentárias por crianças entre meses e 7 anos de idade. A proposta dos pesquisadores é uma pasta que libere pouco fluoreto, e isso é obtido com a diminuição de seu ph. O excesso de fluoreto pode provocar a fluorose, uma doença que deixa manchas esbranquiçadas ou opacas nos dentes em formação, por reação com a hidroxiapatita [Ca 0 (PO 4 ) 6 (OH) 2 ], um sólido presente nas camadas superficiais dos dentes. Nos casos mais graves, essa doença provoca porosidade nos dentes, o que facilita fraturas dos dentes e a absorção de corantes de alimentos. a) Escolha um íon da hidroxiapatita que pode ser substituído pelo fluoreto. Faça a substituição indicando o nome do íon substituído e a respectiva fórmula da substância formada. a) Considerando que a radiação é gerada por uma liga que contém inicialmente 20% de 92 Ir e 80% de 92 Pt, depois de quantos dias essa liga se transformará em uma liga que contém 5% de 92 Ir e 95% de 92 Pt? Mostre seu raciocínio. b) O decaimento radiativo pode originar três diferentes tipos de partículas: a,b e g. Para efeito de resposta ao item, considere apenas a e b. A partícula b tem uma massa igual à massa do elétron, enquanto a partícula a tem uma massa igual à do núcleo do átomo de hélio. Considerando essas informações, que tipo de decaimento sofre o 92 Ir, a ou b? Justifique. a) Analisando-se o gráfico, percebe-se que para uma diminuição da atividade da amostra de 40 para 0 (2 períodos de meiavida), há a passagem de aproximadamente50 dias. Portanto, cada período de meia-vida corresponde a 75 dias. Da mesma maneira, uma liga que possui 20% de 92 Ir (material radioativo) terá percorrido 2 períodos de meiavida até diminuir a porcentagem desse átomo para 5%, ou seja, 50 dias. b) Trata-se de um decaimento com emissão de partículas beta: 92 Ir 92 Pt + b 0 b) Considere que no equilíbrio de solubilidade, a hidroxiapatita libere os íons Ca 2+, PO 4, OH para o meio aquoso próximo à superfície dos dentes. Levando em conta apenas o fator ph do dentifrício, a dissolução da hidroxiapatita seria favorecida, dificultada ou não sofreria alteração com a proposta dos pesquisadores? Justifique. a) O íon da hidroxiapatita que pode ser substituído pelo fluoreto é o íon hidroxila (OH ), pois ambos possuem a mesma valência. A substância formada seria: Ca 0 (PO 4 ) 6 F 2 b) Ca 0 (PO 4 ) 6 (OH) 2 0 Ca PO OH A diminuição do ph (retirada de OH ) desloca o equilíbrio acima para a direita, favorecendo a dissolução da hidroxiapatita.. Um estudo publicado na Revista n o 49 mostra pesquisas sobre a utilização da glicerina (um triol), um subproduto da produção de biodiesel, para obtenção de polipropileno, um plástico amplamente utilizado. A motivação partiu deles e no início achei difícil retirar da glicerina (C H 8 O ) os átomos de oxigênio para transformá-la em propeno (C H 6 ), lembra um pesquisador da Universidade federal do Rio de Janeiro (UFRJ). a) Levando em conta as estruturas das moléculas da glicerina e do propeno, explique por que uma dessas substâncias é gasosa e a outra é líquida em condições ambiente, evidenciando qual é a líquida e qual é a gasosa. CPV UNICAMP200 2a fase
6 6 UNICAMP /0/200 CPV seu pé direito também na Medicina b) O texto da revista ainda informa: 540 kg de óleo a que são acrescentados 54 kg de metanol, resultam em 540 kg de biodiesel e 54 kg de glicerina. Essa glicerina vai resultar em 27 kg de propeno e posteriormente na mesma quantidade de polipropileno. Do ponto de vista rigorosamente estequiométrico e considerando a quantidade de glicerina obtida, a produção de propeno seria maior, menor ou igual à descrita no texto da revista. Justifique. a) A glicerina é líquida à temperatura ambiente, pois suas moléculas formam ligações de hidrogênio entre si devido aos grupos OH presentes em sua estrutura o que eleva seu ponto de ebulição. Já, o propeno é gasoso à temperatura ambiente por ser uma molécula apolar e formar fracas interações intermoleculares chamadas de forças de London. b) Seria menor, segundo cálculo abaixo: glicerina propeno C H 8 O C H 6 mol mol 92 g g 54 kg x x = 24,65 kg (menor que 27 kg) 2. A Revista n 26 veiculou uma notícia sobre uma máquina de lavar que deixa as roupas limpas sem a necessidade de usar produtos alvejantes e elimina praticamente todas as bactérias dos tecidos. O segredo do equipamento é a injeção de íons prata durante a operação de lavagem. A corrente elétrica passa por duas chapas de prata, do tamanho de uma goma de mascar, gerando íons prata, que são lançados na água durante os ciclos de limpeza. a) No seu site, o fabricante informa que a máquina de lavar fornece 00 quadrilhões (00 x 05 ) de íons prata a cada lavagem. Considerando que a máquina seja utilizada vezes por semana, quantos gramas de prata são lançados no ambiente em um ano (52 semanas)? b) Considere que a liberação de íons Ag+ em função do tempo se dá de acordo com o gráfico ao lado. Calcule a corrente em amperes (C/s ) em que a máquina está operando na liberação dos íons. Mostre seu raciocínio. Dado: F = C mol -, Constante de Avogadro= 6,02 x 0 2 mol - a) número de íons = = mol de íons , íons g íons x b) Ag + + e Ag 0 mol mol mol C mol Q Q = x = 2, g = 2,8 mg Do gráfico, retira-se que o tempo é igual a 000 s: Q = i. Dt = i. 000 Þ i = A COMENTÁRIO DO CPV Prova de nível médio de dificuldade. O fator que pode ter atrapalhados os candidatos foi a longa extensão dos enunciados: apesar de claros, o alunos só reconheceria a real intenção do examinador após repetidas leituras. Distribuição de assuntos: Química geral 42% Química Orgânica 8% Físico - Química 25% Radioativida 8% Química Ambiental 7% CPV Unicamp200 2a Fase
RESPOSTAS ESPERADAS QUÍMICA
 Questão 1 Sim, a analogia está correta. Por se tratar de mudança de estado físico, a temperatura do sistema água permanece constante durante o processo de solidificação, assim como ocorre para o caso das
Questão 1 Sim, a analogia está correta. Por se tratar de mudança de estado físico, a temperatura do sistema água permanece constante durante o processo de solidificação, assim como ocorre para o caso das
PROVA DE QUÍMICA 2 o TRIMESTRE DE 2015
 PROVA DE QUÍMICA 2 o TRIMESTRE DE 2015 PROF. MARCOS F. NOME N o 2 a SÉRIE A compreensão do enunciado faz parte da questão. Não faça perguntas ao examinador. A prova deve ser feita com caneta azul ou preta.
PROVA DE QUÍMICA 2 o TRIMESTRE DE 2015 PROF. MARCOS F. NOME N o 2 a SÉRIE A compreensão do enunciado faz parte da questão. Não faça perguntas ao examinador. A prova deve ser feita com caneta azul ou preta.
Tabela Periódica Prof. Esp. Richard Pimenta
 Questão 1. Unesp 2010 (Fase 1) Descoberto neste ano por pesquisadores alemães, o novo elemento químico de número atômico 112 poderá ser batizado de Copernicium, em homenagem ao cientista e astrônomo Nicolau
Questão 1. Unesp 2010 (Fase 1) Descoberto neste ano por pesquisadores alemães, o novo elemento químico de número atômico 112 poderá ser batizado de Copernicium, em homenagem ao cientista e astrônomo Nicolau
E (V) Ag + e Ag 0,80 Zn + 2e Zn 0,76
 PROVA DE QUÍMICA - 2 o TRIMESTRE 2013 PROF. MARCOS NOME N o 2 a SÉRIE A compreensão do enunciado faz parte da questão. Não faça perguntas ao examinador. A prova deve ser feita com caneta azul ou preta.
PROVA DE QUÍMICA - 2 o TRIMESTRE 2013 PROF. MARCOS NOME N o 2 a SÉRIE A compreensão do enunciado faz parte da questão. Não faça perguntas ao examinador. A prova deve ser feita com caneta azul ou preta.
UNIFEV MEDICINA - Segundo Semestre CENTRO UNIVERSITÁRIO DE VOTUPORANGA
 UNIFEV 2015 - MEDICINA - Segundo Semestre CENTRO UNIVERSITÁRIO DE VOTUPORANGA 07. Para combater o subdiagnóstico da osteoporose no sexo masculino, os homens foram o foco da campanha internacional Ame seus
UNIFEV 2015 - MEDICINA - Segundo Semestre CENTRO UNIVERSITÁRIO DE VOTUPORANGA 07. Para combater o subdiagnóstico da osteoporose no sexo masculino, os homens foram o foco da campanha internacional Ame seus
QUÍMICA Exercícios de revisão resolvidos
 9. (ENEM 2013) A produção de aço envolve o aquecimento do minério de ferro, junto com carvão (carbono) e ar atmosférico em uma série de reações de oxirredução. O produto é chamado de ferro-gusa e contém
9. (ENEM 2013) A produção de aço envolve o aquecimento do minério de ferro, junto com carvão (carbono) e ar atmosférico em uma série de reações de oxirredução. O produto é chamado de ferro-gusa e contém
20 Não se fazem mais nobres como antigamente pelo menos na Química. (Folha de S. Paulo, ). As descobertas de compostos como o XePtF 6
 20 Não se fazem mais nobres como antigamente pelo menos na Química. (Folha de S. Paulo, 17.08.2000). As descobertas de compostos como o XePtF 6, em 1962, e o HArF, recentemente obtido, contrariam a crença
20 Não se fazem mais nobres como antigamente pelo menos na Química. (Folha de S. Paulo, 17.08.2000). As descobertas de compostos como o XePtF 6, em 1962, e o HArF, recentemente obtido, contrariam a crença
UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2011 DO CURSO DE MESTRADO
 UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2011 DO CURSO DE MESTRADO 08/11/2010 PROVA ESCRITA Assinatura do candidato: Área de concentração:
UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2011 DO CURSO DE MESTRADO 08/11/2010 PROVA ESCRITA Assinatura do candidato: Área de concentração:
Semana 09. A queima do carvão é representada pela equação química:
 . (Enem 6) O benzeno, um importante solvente para a indústria química, é obtido industrialmente pela destilação do petróleo. Contudo, também pode ser sintetizado pela trimerização do acetileno catalisada
. (Enem 6) O benzeno, um importante solvente para a indústria química, é obtido industrialmente pela destilação do petróleo. Contudo, também pode ser sintetizado pela trimerização do acetileno catalisada
CPV seu pé direito também na Medicina
 seu pé direito também na Medicina UNIFESP 17/dezembro/2010 QUÍMICA 06. Ligas metálicas são comuns no cotidiano e muito utilizadas nas indústrias automobilística, aeronáutica, eletrônica e na construção
seu pé direito também na Medicina UNIFESP 17/dezembro/2010 QUÍMICA 06. Ligas metálicas são comuns no cotidiano e muito utilizadas nas indústrias automobilística, aeronáutica, eletrônica e na construção
Vestibular UFRGS 2013 Resolução da Prova de Química
 Vestibular UFRGS 2013 Resolução da Prova de Química 26. Alternativa (B) Somente os fenômenos químicos constituem uma Reação Química, portanto: I fenômeno físico. II fenômeno químico III fenômeno físico
Vestibular UFRGS 2013 Resolução da Prova de Química 26. Alternativa (B) Somente os fenômenos químicos constituem uma Reação Química, portanto: I fenômeno físico. II fenômeno químico III fenômeno físico
UFSC. Resposta: = 40. Comentário
 Resposta: 08 + 32 = 40 01. Incorreta. O butano não possui isomeria óptica, pois não possui carbono assimétrico. 02. Incorreta. Ao serem liberados para a atmosfera os gases sofrem expansão de volume. 04.
Resposta: 08 + 32 = 40 01. Incorreta. O butano não possui isomeria óptica, pois não possui carbono assimétrico. 02. Incorreta. Ao serem liberados para a atmosfera os gases sofrem expansão de volume. 04.
PROVA DE QUÍMICA. Tendo em vista as propriedades coligativas dessas soluções, é CORRETO afirmar
 17 PROVA DE QUÍMICA Q U E S T Ã O 2 6 Z e X são elementos químicos que apresentam respectivamente 2 e 6 elétrons no nível de valência. A fórmula química resultante da combinação entre átomos dos elementos
17 PROVA DE QUÍMICA Q U E S T Ã O 2 6 Z e X são elementos químicos que apresentam respectivamente 2 e 6 elétrons no nível de valência. A fórmula química resultante da combinação entre átomos dos elementos
INTRODUÇÃO À QUÍMICA
 INTRODUÇÃO À QUÍMICA O QUE É QUÍMICA? É a ciência que estuda a matéria, suas propriedades, transformações e interações, bem como a energia envolvida nestes processos. QUAL A IMPORTÂNCIA DA QUÍMICA? Entender
INTRODUÇÃO À QUÍMICA O QUE É QUÍMICA? É a ciência que estuda a matéria, suas propriedades, transformações e interações, bem como a energia envolvida nestes processos. QUAL A IMPORTÂNCIA DA QUÍMICA? Entender
QUÍMICA QUESTÃO 1 EXPECTATIVA DE RESPOSTA
 QUÍMICA 1 O etanol, combustível produzido em grande escala no Brasil, pode ser obtido pela fermentação da sacarose encontrada na cana-de-açúcar. Esse processo consiste na degradação por enzimas de micro-organismos
QUÍMICA 1 O etanol, combustível produzido em grande escala no Brasil, pode ser obtido pela fermentação da sacarose encontrada na cana-de-açúcar. Esse processo consiste na degradação por enzimas de micro-organismos
PROVA DE QUÍMICA SEGUNDA ETAPA DO VESTIBULAR 99 DA UFMG
 PROVA DE QUÍMICA SEGUNDA ETAPA DO VESTIBULAR 99 DA UFMG QUESTÃO 01 A queima do enxofre produz um dos seus óxidos, SO 2 (g) ou SO 3 (g). A identificação de qual dos dois é, realmente, produzido pode ser
PROVA DE QUÍMICA SEGUNDA ETAPA DO VESTIBULAR 99 DA UFMG QUESTÃO 01 A queima do enxofre produz um dos seus óxidos, SO 2 (g) ou SO 3 (g). A identificação de qual dos dois é, realmente, produzido pode ser
Pb 2e Pb E 0,13 v. Ag 2e Ag E +0,80 v. Zn 2e Zn E 0,76 v. Al 3e Al E 1,06 v. Mg 2e Mg E 2,4 v. Cu 2e Cu E +0,34 v
 QUÍMICA 1ª QUESTÃO Umas das reações possíveis para obtenção do anidrido sulfúrico é a oxidação do anidrido sulfuroso por um agente oxidante forte em meio aquoso ácido, como segue a reação. Anidrido sulfuroso
QUÍMICA 1ª QUESTÃO Umas das reações possíveis para obtenção do anidrido sulfúrico é a oxidação do anidrido sulfuroso por um agente oxidante forte em meio aquoso ácido, como segue a reação. Anidrido sulfuroso
FUVEST 1981 Primeira fase e Segunda fase
 FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
Everton e Bruno Steger
 Everton e Bruno Steger PROBLEMA 01: Poder calorífico em kj por grama (Etanol) 46g 1400 kj 1g X X = 30,4 kj O poder calorífico do etanol é 30,4 kj/grama. (Octano) 114g 5400 kj 1g Y Y = 47,4 kj O poder calorífico
Everton e Bruno Steger PROBLEMA 01: Poder calorífico em kj por grama (Etanol) 46g 1400 kj 1g X X = 30,4 kj O poder calorífico do etanol é 30,4 kj/grama. (Octano) 114g 5400 kj 1g Y Y = 47,4 kj O poder calorífico
FUVEST 1985 Primeira fase e Segunda fase
 FUVEST 1985 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 85. Qual o método de separação utilizado quanto se usa um coador de pano na preparação do café? a) destilação b) filtração c) decantação d)
FUVEST 1985 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 85. Qual o método de separação utilizado quanto se usa um coador de pano na preparação do café? a) destilação b) filtração c) decantação d)
Vestibular UFSC 2005 (Branca) Química
 Química Geral da Equipe de Química do Curso Energia (Professores Miron, Callegaro, Romero e Pedro Marcos) A CCCV da UFSC está de parabéns pela elaboração das questões da prova de Química, dando prioridade
Química Geral da Equipe de Química do Curso Energia (Professores Miron, Callegaro, Romero e Pedro Marcos) A CCCV da UFSC está de parabéns pela elaboração das questões da prova de Química, dando prioridade
01 O chumbo participa da composição de diversas ligas metálicas. No bronze arquitetônico, por
 01 O chumbo participa da composição de diversas ligas metálicas. No bronze arquitetônico, por exemplo, o teor de chumbo corresponde a 4,14% em massa da liga. Seu isótopo radioativo 210 Pb decai pela emissão
01 O chumbo participa da composição de diversas ligas metálicas. No bronze arquitetônico, por exemplo, o teor de chumbo corresponde a 4,14% em massa da liga. Seu isótopo radioativo 210 Pb decai pela emissão
O aluno deverá elaborar resumos teóricos dos textos do livro e de outras fontes sobre os tópicos do conteúdo.
 Disciplina QUÍMICA Curso ENSINO MÉDIO Professor GUILHERME Série 1ª SÉRIE ROTEIRO DE ESTUDOS DE RECUPERAÇÃO E REVISÃO 1º SEMESTRE / 2012 Aluno (a): Número: 1 - Conteúdo: Ácidos e bases propriedades, conceito
Disciplina QUÍMICA Curso ENSINO MÉDIO Professor GUILHERME Série 1ª SÉRIE ROTEIRO DE ESTUDOS DE RECUPERAÇÃO E REVISÃO 1º SEMESTRE / 2012 Aluno (a): Número: 1 - Conteúdo: Ácidos e bases propriedades, conceito
UFJF CONCURSO VESTIBULAR PROVA DE QUÍMICA
 Questão 1 Sabe-se que compostos constituídos por elementos do mesmo grupo na tabela periódica possuem algumas propriedades químicas semelhantes. Entretanto, enquanto a água é líquida em condições normais
Questão 1 Sabe-se que compostos constituídos por elementos do mesmo grupo na tabela periódica possuem algumas propriedades químicas semelhantes. Entretanto, enquanto a água é líquida em condições normais
QUÍMICA PRIMEIRA ETAPA
 QUÍMICA PRIMEIRA ETAPA - 1998 QUESTÃO 01 Uma mistura de hidrogênio, H 2 (g), e oxigênio, O 2 (g), reage, num recipiente hermeticamente fechado, em alta temperatura e em presença de um catalisador, produzindo
QUÍMICA PRIMEIRA ETAPA - 1998 QUESTÃO 01 Uma mistura de hidrogênio, H 2 (g), e oxigênio, O 2 (g), reage, num recipiente hermeticamente fechado, em alta temperatura e em presença de um catalisador, produzindo
FACULDADE ISRAELITA DE CIÊNCIAS DA SAÚDE ALBERT EINSTEIN 2019
 FACULDADE ISRAELITA DE CIÊNCIAS DA SAÚDE ALBERT EINSTEIN 2019 CNHECIMENTS GERAIS E ESPECÍFICS CNHECIMENTS GERAIS 31. quadro apresenta informações sobre quatro substâncias químicas, todas brancas, em pó.
FACULDADE ISRAELITA DE CIÊNCIAS DA SAÚDE ALBERT EINSTEIN 2019 CNHECIMENTS GERAIS E ESPECÍFICS CNHECIMENTS GERAIS 31. quadro apresenta informações sobre quatro substâncias químicas, todas brancas, em pó.
PROVA DE QUÍMICA TABELA PERIÓDICA DOS ELEMENTOS
 PROVA DE QUÍMICA TABELA PERIÓDICA DOS ELEMENTOS FONTE: Tabela Periódica da IUPAC/versão 2005(adaptada). Acesso: http://www.iupac.org/reports/periodic_table/ 25 QUESTÃO 3 Analise este quadro, em que se
PROVA DE QUÍMICA TABELA PERIÓDICA DOS ELEMENTOS FONTE: Tabela Periódica da IUPAC/versão 2005(adaptada). Acesso: http://www.iupac.org/reports/periodic_table/ 25 QUESTÃO 3 Analise este quadro, em que se
com o oxigênio, formando o trióxido de enxofre (SO 3 ), e deste com a água, resultando no H 2
 11 Em 2004 iniciou-se, no Brasil, a exploração de uma importante jazida de minério de cobre. Nestes minérios, o metal é normalmente encontrado na forma de sulfetos, como o CuS, e para sua obtenção o minério
11 Em 2004 iniciou-se, no Brasil, a exploração de uma importante jazida de minério de cobre. Nestes minérios, o metal é normalmente encontrado na forma de sulfetos, como o CuS, e para sua obtenção o minério
a) Escreva os nomes das substâncias presentes nos frascos A, B e C. A B C
 PROVA DE QUÍMICA 2ª ETAPA do VESTIBULAR 2006 (cada questão desta prova vale até cinco pontos) Questão 01 Foram encontrados, em um laboratório, três frascos A, B e C, contendo soluções incolores e sem rótulos.
PROVA DE QUÍMICA 2ª ETAPA do VESTIBULAR 2006 (cada questão desta prova vale até cinco pontos) Questão 01 Foram encontrados, em um laboratório, três frascos A, B e C, contendo soluções incolores e sem rótulos.
XIII Olimpíada Baiana de Química Exame 2018
 GABARITO Questões discursivas Data da aplicação da prova: 04/08/2018 Data da publicação do gabarito: 05/10/2018 Questão 01 (Peso 3) Uma fita de magnésio com dimensão de 2,0 cm foi aquecida em uma chama
GABARITO Questões discursivas Data da aplicação da prova: 04/08/2018 Data da publicação do gabarito: 05/10/2018 Questão 01 (Peso 3) Uma fita de magnésio com dimensão de 2,0 cm foi aquecida em uma chama
AULA 10 ESTEQUIOMETRIA
 AULA 10 ESTEQUIOMETRIA Cálculo estequiométrico ou estequiometria é o cálculo de quantidades de substâncias que interagem, pode ser do reagente consumido ou do produto formado. Baseia-se nas proporções
AULA 10 ESTEQUIOMETRIA Cálculo estequiométrico ou estequiometria é o cálculo de quantidades de substâncias que interagem, pode ser do reagente consumido ou do produto formado. Baseia-se nas proporções
LISTA DE EXERCÍCIOS: TRANSFORMAÇÕES FÍSICAS E QUÍMICAS PROPRIEDADES FÍSICAS E QUÍMICAS ALGARISMOS SIGNIFICATIVOS ESTEQUIOMETRIA
 UNIVERSIDADE FEDERAL D ESTAD D RI DE JANEIR (UNIRI) INSTITUT DE BICIÊNCIAS DEP. DE CIÊNCIAS NATURAIS DISCIPLINA: QUÍMICA GERAL E INRGÂNICA 2/2015 PRFª.: CLAUDIA JRGE D NASCIMENT LISTA DE EXERCÍCIS: MATÉRIA
UNIVERSIDADE FEDERAL D ESTAD D RI DE JANEIR (UNIRI) INSTITUT DE BICIÊNCIAS DEP. DE CIÊNCIAS NATURAIS DISCIPLINA: QUÍMICA GERAL E INRGÂNICA 2/2015 PRFª.: CLAUDIA JRGE D NASCIMENT LISTA DE EXERCÍCIS: MATÉRIA
QUÍMICA. em 100mL dessa solução.
 QUÍMICA 36. Essa questão trata sobre soluções aquosas e as diferentes formas de expressar suas concentrações. Trata ainda de suas propriedades e das reações que podem ocorrer entre elas. 0 0 A concentração
QUÍMICA 36. Essa questão trata sobre soluções aquosas e as diferentes formas de expressar suas concentrações. Trata ainda de suas propriedades e das reações que podem ocorrer entre elas. 0 0 A concentração
LISTA 02 - TEORIA ATÔMICA MOLECULAR
 LISTA 02 - TEORIA ATÔMICA MOLECULAR 1º ano QUÍMICA PROF. PEDRO 2º Bimestre Questão 01) A massa de uma molécula de ácido acético, CH 3 COOH, é: a) 1,0. 10-21 g b) 1,0. 10-22 g c) 1,0. 10-23 g d) 1,0. 10-24
LISTA 02 - TEORIA ATÔMICA MOLECULAR 1º ano QUÍMICA PROF. PEDRO 2º Bimestre Questão 01) A massa de uma molécula de ácido acético, CH 3 COOH, é: a) 1,0. 10-21 g b) 1,0. 10-22 g c) 1,0. 10-23 g d) 1,0. 10-24
UFU 2008/2-1ª FASE. 1-A substância, representada pela fórmula estrutural abaixo, é bastante utilizada como analgésico (aspirina).
 UFU 2008/2-1ª FASE 1-A substância, representada pela fórmula estrutural abaixo, é bastante utilizada como analgésico (aspirina). Com base nessas informações, marque a alternativa correta. A) Uma massa
UFU 2008/2-1ª FASE 1-A substância, representada pela fórmula estrutural abaixo, é bastante utilizada como analgésico (aspirina). Com base nessas informações, marque a alternativa correta. A) Uma massa
Disciplina: Química Data: 05 / 05 / Ensino Médio Série: 2º ano Turma: Valor: Média: Assunto: ROTEIRO DE RECUPERAÇÃO Etapa: I Tipo:
 Disciplina: Química Data: 05 / 05 / 2018 Ensino Médio Série: 2º ano Turma: Valor: Média: Assunto: ROTEIRO DE RECUPERAÇÃO Etapa: I Tipo: Aluno(a): Nº: Nota: Professor(a): Thito Ass. do(a) Responsável: PROGRAMA
Disciplina: Química Data: 05 / 05 / 2018 Ensino Médio Série: 2º ano Turma: Valor: Média: Assunto: ROTEIRO DE RECUPERAÇÃO Etapa: I Tipo: Aluno(a): Nº: Nota: Professor(a): Thito Ass. do(a) Responsável: PROGRAMA
FUVEST 1984 Primeira fase e Segunda fase
 FUVEST 1984 Primeira fase e Segunda fase Professora Sonia 9. A melhor maneira de separar os três componentes de uma mistura de areia com solução aquosa de sal é: CONHECIMENTOS GERAIS 5. O peso atômico
FUVEST 1984 Primeira fase e Segunda fase Professora Sonia 9. A melhor maneira de separar os três componentes de uma mistura de areia com solução aquosa de sal é: CONHECIMENTOS GERAIS 5. O peso atômico
REVISÃO DE FÉRIAS C H
 1. (Unesp) Analise os três diagramas de entalpia. REVISÃO DE FÉRIAS O H da combustão completa de 1mol de acetileno, a) b) c) d) e) 1.140 kj. 820 kj. 1.299 kj. 510 kj. 635 kj. C2H 2(g), produzindo CO 2(g)
1. (Unesp) Analise os três diagramas de entalpia. REVISÃO DE FÉRIAS O H da combustão completa de 1mol de acetileno, a) b) c) d) e) 1.140 kj. 820 kj. 1.299 kj. 510 kj. 635 kj. C2H 2(g), produzindo CO 2(g)
Seu pé direito nas melhores faculdades
 Seu pé direito nas melhores faculdades FUVEST 2 a Fase 11/janeiro/2011 QUÍMICA 01. s componentes principais dos óleos vegetais são os triglicerídeos, que possuem a seguinte fórmula genérica: Nessa fórmula,
Seu pé direito nas melhores faculdades FUVEST 2 a Fase 11/janeiro/2011 QUÍMICA 01. s componentes principais dos óleos vegetais são os triglicerídeos, que possuem a seguinte fórmula genérica: Nessa fórmula,
B) Defina a que forma de apresentação do alumínio corresponde cada uma das curvas. Justifique sua resposta.
 Questão 01 PROVA DISCURSIVA QUÍMICA O gráfico abaixo representa a variação, em função do tempo, da concentração, em quantidade de matéria, do hidrogênio gasoso formado em duas reações químicas de alumínio
Questão 01 PROVA DISCURSIVA QUÍMICA O gráfico abaixo representa a variação, em função do tempo, da concentração, em quantidade de matéria, do hidrogênio gasoso formado em duas reações químicas de alumínio
Observe o gráfico, cujas curvas representam as variações das massas desses radioisótopos ao longo das duas horas de duração do experimento.
 Revisão Específicas 1. (UERJ 2015) Os preços dos metais para reciclagem variam em função da resistência de cada um à corrosão: quanto menor a tendência do metal à oxidação, maior será o preço. Na tabela,
Revisão Específicas 1. (UERJ 2015) Os preços dos metais para reciclagem variam em função da resistência de cada um à corrosão: quanto menor a tendência do metal à oxidação, maior será o preço. Na tabela,
QUÍMICA. A distribuição eletrônica para o mercúrio elementar é. a) [Kr] 4d 10 5p 6. b) [Ar] 3d 10 4p 4. c) [Rn] 5f 14 6d 6. d) [Xe] 6s 2 4f 14 5d 10.
![QUÍMICA. A distribuição eletrônica para o mercúrio elementar é. a) [Kr] 4d 10 5p 6. b) [Ar] 3d 10 4p 4. c) [Rn] 5f 14 6d 6. d) [Xe] 6s 2 4f 14 5d 10. QUÍMICA. A distribuição eletrônica para o mercúrio elementar é. a) [Kr] 4d 10 5p 6. b) [Ar] 3d 10 4p 4. c) [Rn] 5f 14 6d 6. d) [Xe] 6s 2 4f 14 5d 10.](/thumbs/55/36491621.jpg) QUÍMICA 01 A toxicidade do mercúrio (Hg) já é conhecida de longa data, e não se tem notícia de que ele seja essencial ao organismo humano. Devido ao elevado teor desse metal em lâmpadas fluorescentes,
QUÍMICA 01 A toxicidade do mercúrio (Hg) já é conhecida de longa data, e não se tem notícia de que ele seja essencial ao organismo humano. Devido ao elevado teor desse metal em lâmpadas fluorescentes,
O diagrama abaixo relaciona a solubilidade de dois sais A e B com a temperatura.
 13 PRVA D E Q U Í M I C A Q U E S T Ã 21 diagrama abaixo relaciona a solubilidade de dois sais A e B com a temperatura. Com relação ao diagrama, é INCRRET afirmar que: a) a 100ºC, a solubilidade de B é
13 PRVA D E Q U Í M I C A Q U E S T Ã 21 diagrama abaixo relaciona a solubilidade de dois sais A e B com a temperatura. Com relação ao diagrama, é INCRRET afirmar que: a) a 100ºC, a solubilidade de B é
Prof. Msc João Neto 2
 Prof. Msc João Neto Prof. Msc João Neto 2 C 12 9 108 H 1 8 8 C9H8O4 O 16 4 64 180g / mol 180g N moléculas 500 10 3 g y 3 500 10 g N y 180g y 2,77 10 3 N moléculas C H O 9 8 4 C 12 9 108 H 1 8 8 O 16 4
Prof. Msc João Neto Prof. Msc João Neto 2 C 12 9 108 H 1 8 8 C9H8O4 O 16 4 64 180g / mol 180g N moléculas 500 10 3 g y 3 500 10 g N y 180g y 2,77 10 3 N moléculas C H O 9 8 4 C 12 9 108 H 1 8 8 O 16 4
SIMULADO de QUÍMICA 1 os anos 2008 TODOS COLÉGIOS
 SIMULADO de QUÍMICA 1 os anos 2008 TODOS COLÉGIOS 1) Em relação às partículas atômicas, a alternativa falsa é: a) a massa do próton é igual a massa do elétron. b) a massa do elétron é menor que a massa
SIMULADO de QUÍMICA 1 os anos 2008 TODOS COLÉGIOS 1) Em relação às partículas atômicas, a alternativa falsa é: a) a massa do próton é igual a massa do elétron. b) a massa do elétron é menor que a massa
2-A ductilidade é a propriedade de um material deformar-se, comprimir-se ou estirar-se sem se romper.
 UNESP 2012 1-O magma que sai dos vulcões durante as erupções é constituído por rochas fundidas e vários tipos de gases e vapores, tais como CO, CO 2, SO 2, SO 3, HCl e H 2 O. A respeito dessas substâncias,
UNESP 2012 1-O magma que sai dos vulcões durante as erupções é constituído por rochas fundidas e vários tipos de gases e vapores, tais como CO, CO 2, SO 2, SO 3, HCl e H 2 O. A respeito dessas substâncias,
Na(s) questão(ões) a seguir, escreva no espaço apropriado a soma dos itens corretos.
 Na(s) questão(ões) a seguir, escreva no espaço apropriado a soma dos itens corretos. 1. Dados os potenciais de oxi-redução a seguir, Ag + 1e Ï Ag Fe + 2e Ï Fe Ag + 3e Ï Al Cu + 2e Ï Cu E = +0,80V E = -0,44V
Na(s) questão(ões) a seguir, escreva no espaço apropriado a soma dos itens corretos. 1. Dados os potenciais de oxi-redução a seguir, Ag + 1e Ï Ag Fe + 2e Ï Fe Ag + 3e Ï Al Cu + 2e Ï Cu E = +0,80V E = -0,44V
PROVA 3 conhecimentos específicos
 PROVA 3 conhecimentos específicos Química QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE química. UEM Comissão Central do Vestibular Unificado GABARITO
PROVA 3 conhecimentos específicos Química QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE química. UEM Comissão Central do Vestibular Unificado GABARITO
PROVA 3 conhecimentos específicos
 PROVA 3 conhecimentos específicos QUÍMICA QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado GABARITO
PROVA 3 conhecimentos específicos QUÍMICA QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado GABARITO
PROVA 3 conhecimentos específicos
 PROVA 3 conhecimentos específicos QUÍMICA QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado GABARITO
PROVA 3 conhecimentos específicos QUÍMICA QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado GABARITO
PUC Goiás MAF Coordenação de Química Lista de exercícios transformações Químicas Profa Sandra R. Longhin Goiânia. 05 de abril de 2011
 1 PUC Goiás MAF Coordenação de Química Lista de exercícios transformações Químicas Profa Sandra R. Longhin Goiânia. 05 de abril de 2011 01. A temperatura de ebulição é, entre outras, uma propriedade das
1 PUC Goiás MAF Coordenação de Química Lista de exercícios transformações Químicas Profa Sandra R. Longhin Goiânia. 05 de abril de 2011 01. A temperatura de ebulição é, entre outras, uma propriedade das
FUVEST 2015 (Questões 1 a 6)
 (Questões 1 a 6) Provas de Vestibular 1. O metabissulfito de potássio (K 2 S2O 5 ) e o dióxido de enxofre (SO 2 ) são amplamente utilizados na conservação de alimentos como sucos de frutas, retardando
(Questões 1 a 6) Provas de Vestibular 1. O metabissulfito de potássio (K 2 S2O 5 ) e o dióxido de enxofre (SO 2 ) são amplamente utilizados na conservação de alimentos como sucos de frutas, retardando
TERMOQUÍMICA EXERCÍCIOS PARA TREINO
 TERMOQUÍMICA EXERCÍCIOS PARA TREINO 1 - Considere a seguinte reação termoquímica: 2NO(g) + O 2 (g) 2NO 2 (g) H = -13,5 kcal / mol de NO e assinale a alternativa falsa. a) A reação é exotérmica. b) São
TERMOQUÍMICA EXERCÍCIOS PARA TREINO 1 - Considere a seguinte reação termoquímica: 2NO(g) + O 2 (g) 2NO 2 (g) H = -13,5 kcal / mol de NO e assinale a alternativa falsa. a) A reação é exotérmica. b) São
COLÉGIO DA POLÍCIA MILITAR
 COLÉGIO DA POLÍCIA MILITAR ASSESSORIA TÉCNICA Processo Avaliativo Recuperação - 3º Bimestre/2015 Disciplina: QUÍMICA 3ª série EM A/B Nome do aluno Nº Turma A Recuperação deve ser entregue no dia 08/09/2015.
COLÉGIO DA POLÍCIA MILITAR ASSESSORIA TÉCNICA Processo Avaliativo Recuperação - 3º Bimestre/2015 Disciplina: QUÍMICA 3ª série EM A/B Nome do aluno Nº Turma A Recuperação deve ser entregue no dia 08/09/2015.
Atividades de Recuperação Paralela de Química 2º. trimestre
 Atividades de Recuperação Paralela de Química 2º. trimestre 3ª série Ensino Médio Conteúdos para estudos:. Setor A: Equações de desintegrações alfa e beta; Cálculos envolvendo tempo de meia vida; Modelos
Atividades de Recuperação Paralela de Química 2º. trimestre 3ª série Ensino Médio Conteúdos para estudos:. Setor A: Equações de desintegrações alfa e beta; Cálculos envolvendo tempo de meia vida; Modelos
NOX EXERCÍCIOS QUÍMICA PROF- LEONARDO. 01)Quais são os números de oxidação do iodo nas substâncias l 2, Nal, NalO 4 e Al I 3?
 NOX EXERCÍCIOS QUÍMICA PROF- LEONARDO 01)Quais são os números de oxidação do iodo nas substâncias l 2, Nal, NalO 4 e Al I 3? 02. O número de oxidação do manganês no permanganato de potássio (KMnO4) é:
NOX EXERCÍCIOS QUÍMICA PROF- LEONARDO 01)Quais são os números de oxidação do iodo nas substâncias l 2, Nal, NalO 4 e Al I 3? 02. O número de oxidação do manganês no permanganato de potássio (KMnO4) é:
RESOLUÇÃO DA PROVA DE QUÍMICA - UFRGS 2019
 RESOLUÇÃO DA PROVA DE QUÍMICA - UFRGS 2019 26. Resposta letra C O estado gasoso é um fluido. As propriedades do líquido são intermediárias entre sólido e gasoso. 27. Resposta letra A A dissolução fracionada
RESOLUÇÃO DA PROVA DE QUÍMICA - UFRGS 2019 26. Resposta letra C O estado gasoso é um fluido. As propriedades do líquido são intermediárias entre sólido e gasoso. 27. Resposta letra A A dissolução fracionada
UFSC. Química (Amarela) , temos 10 mol de Mg, ou seja, 243 g de Mg. Resposta: = 98. Comentário
 Resposta: 02 + 32 + 64 = 98 01. Incorreta. carbonato de magnésio é um sal insolúvel em H 2, logo não dissocia-se em Mg 2+ e (aq) C2. 3(aq) 02. Correta. 12 Mg 2+ = 1s 2 2s 2 2p 6 K L 04. Incorreta. É um
Resposta: 02 + 32 + 64 = 98 01. Incorreta. carbonato de magnésio é um sal insolúvel em H 2, logo não dissocia-se em Mg 2+ e (aq) C2. 3(aq) 02. Correta. 12 Mg 2+ = 1s 2 2s 2 2p 6 K L 04. Incorreta. É um
Gabarito das Questões
 II OLIMPÍADA BAIANA DE QUÍMICA 19 DE MAIO DE 2007 Gabarito das Questões Para cada questão de 1 a 5, marque com um X a alternativa correta e justifique porque as outras duas estão erradas. QUESTÃO 1 a)
II OLIMPÍADA BAIANA DE QUÍMICA 19 DE MAIO DE 2007 Gabarito das Questões Para cada questão de 1 a 5, marque com um X a alternativa correta e justifique porque as outras duas estão erradas. QUESTÃO 1 a)
Trabalho de Recuperação Final 2018
 Nome Nº Turma 1A1AC Nome do Professor Claudia Figueiredo /12/18 Nome da Disciplina: QUÍMICA Trabalho de Recuperação Final 2018 Valor do trabalho: de zero a dois pontos. Conteúdo: Ap5- Estequiometria e
Nome Nº Turma 1A1AC Nome do Professor Claudia Figueiredo /12/18 Nome da Disciplina: QUÍMICA Trabalho de Recuperação Final 2018 Valor do trabalho: de zero a dois pontos. Conteúdo: Ap5- Estequiometria e
USCS MEDICINA - Segundo Semestre UNIVERSIDADE MUNICIPAL DE SÃO CAETANO DO SUL
 USS 017 - MEDIINA - Segundo Semestre UNIVERSIDADE MUNIIPAL DE SÃO AETANO DO SUL 01. O sulfato de amônio, (N 4) SO 4, é um sal inorgânico empregado como aditivo em herbicidas. Uma de suas funções é a diminuição
USS 017 - MEDIINA - Segundo Semestre UNIVERSIDADE MUNIIPAL DE SÃO AETANO DO SUL 01. O sulfato de amônio, (N 4) SO 4, é um sal inorgânico empregado como aditivo em herbicidas. Uma de suas funções é a diminuição
Resolução de Questões de Provas Específicas de Química (Aula 7)
 Resolução de Questões de Provas Específicas de Química (Aula 7) Resolução de Questões de Provas Específicas (Aula 7) 1. (UECE) A tabela periódica já era objeto das preocupações dos antigos químicos a partir
Resolução de Questões de Provas Específicas de Química (Aula 7) Resolução de Questões de Provas Específicas (Aula 7) 1. (UECE) A tabela periódica já era objeto das preocupações dos antigos químicos a partir
Exercícios sobre Termoquímica- lei de hess
 Exercícios sobre Termoquímica- lei de hess 0. (UNESP - adaptada) Definir, ou conceituar, e discutir, usando exemplos quando julgar conveniente: a) entalpia molar padrão de formação de uma substância; b)
Exercícios sobre Termoquímica- lei de hess 0. (UNESP - adaptada) Definir, ou conceituar, e discutir, usando exemplos quando julgar conveniente: a) entalpia molar padrão de formação de uma substância; b)
NOME: ANO: 2º ENSINO: MÉDIO TURMA: DATA: / / PROF(ª).: Luciano Raposo Freitas EXERCÍCIOS TERMOQUÍMICA QUÍMICA II (2º BIM)
 NOME: ANO: 2º ENSINO: MÉDIO TURMA: DATA: / / PROF(ª).: Luciano Raposo Freitas EXERCÍCIOS TERMOQUÍMICA QUÍMICA II (2º BIM) 1. Nos motores de explosão existentes hoje em dia utiliza-se uma mistura de gasolina
NOME: ANO: 2º ENSINO: MÉDIO TURMA: DATA: / / PROF(ª).: Luciano Raposo Freitas EXERCÍCIOS TERMOQUÍMICA QUÍMICA II (2º BIM) 1. Nos motores de explosão existentes hoje em dia utiliza-se uma mistura de gasolina
UFSC. Química (Amarela) Resposta: = 05
 Resposta: 01 + 04 = 05 01. Correto. Apresenta carboxila e grupamento amino no carbono alfa. 02. Incorreto. Com a elevação do ph ocorre a desprotonação da carboxila formando carga negativa. 04. Correto.
Resposta: 01 + 04 = 05 01. Correto. Apresenta carboxila e grupamento amino no carbono alfa. 02. Incorreto. Com a elevação do ph ocorre a desprotonação da carboxila formando carga negativa. 04. Correto.
Os estados físicos da matéria sólido, líquido e gasoso são chamados também de estados de agregação da matéria. No esquema abaixo,
 QUÍMICA (QUESTÕES 1 10) QUESTÃO 1 Os estados físicos da matéria sólido, líquido e gasoso são chamados também de estados de agregação da matéria. No esquema abaixo, marque a alternativa que representa CORRETAMENTE
QUÍMICA (QUESTÕES 1 10) QUESTÃO 1 Os estados físicos da matéria sólido, líquido e gasoso são chamados também de estados de agregação da matéria. No esquema abaixo, marque a alternativa que representa CORRETAMENTE
EXERCÍCIOS DE REVISÃO P/ Avaliação 01/06
 Tema do Ano: Eu e o outro construindo um mundo mais solidário Projeto Interdisciplinar da 2 a Série do Ensino Médio: Segunda metade do século XX e início do século XXI: movimentos, conflitos e desenvolvimento.
Tema do Ano: Eu e o outro construindo um mundo mais solidário Projeto Interdisciplinar da 2 a Série do Ensino Médio: Segunda metade do século XX e início do século XXI: movimentos, conflitos e desenvolvimento.
Especial Específicas (UNIFESP, UNESP, UEPG)
 Especial Específicas (UNIFESP, UNESP, UEPG) 1. (UNIFESP) Os polímeros fazem parte do nosso cotidiano e suas propriedades, como temperatura de fusão, massa molar, densidade, reatividade química, dentre
Especial Específicas (UNIFESP, UNESP, UEPG) 1. (UNIFESP) Os polímeros fazem parte do nosso cotidiano e suas propriedades, como temperatura de fusão, massa molar, densidade, reatividade química, dentre
BIMESTRAL QUÍMICA - 1ºBIMESTRE
 BIMESTRAL QUÍMICA - 1ºBIMESTRE Série: 3ªEM Gabarito Questão 01) O vapor obtido pela ebulição das seguintes soluções: I. água e sal II. água e açúcar III. água e álcool é constituído de água pura apenas:
BIMESTRAL QUÍMICA - 1ºBIMESTRE Série: 3ªEM Gabarito Questão 01) O vapor obtido pela ebulição das seguintes soluções: I. água e sal II. água e açúcar III. água e álcool é constituído de água pura apenas:
IME º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR
 IME - 2003 3º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR Química Questão 01 Uma fonte de vanádio é o mineral vanadinita, cuja fórmula é Pb 5 (VO 4 ) 3 Cl. DETERMINE: A) A porcentagem em massa de vanádio
IME - 2003 3º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR Química Questão 01 Uma fonte de vanádio é o mineral vanadinita, cuja fórmula é Pb 5 (VO 4 ) 3 Cl. DETERMINE: A) A porcentagem em massa de vanádio
ATENÇÃO ESTE CADERNO CONTÉM 10 (DEZ) QUESTÕES. VERIFIQUE SE ESTÁ COMPLETO. DURAÇÃO DA PROVA: 3 (TRÊS) HORAS
 ATENÇÃO ESTE CADERNO CONTÉM 10 (DEZ) QUESTÕES. VERIFIQUE SE ESTÁ COMPLETO. DURAÇÃO DA PROVA: 3 (TRÊS) HORAS A correção de uma questão será restrita somente ao que estiver apresentado no espaço correspondente,
ATENÇÃO ESTE CADERNO CONTÉM 10 (DEZ) QUESTÕES. VERIFIQUE SE ESTÁ COMPLETO. DURAÇÃO DA PROVA: 3 (TRÊS) HORAS A correção de uma questão será restrita somente ao que estiver apresentado no espaço correspondente,
SIMULADO de QUÍMICA 2 os anos 2008 TODOS COLÉGIOS
 SIMULADO de QUÍMICA 2 os anos 2008 TODOS COLÉGIOS ) Foram misturados 400 mililitros de solução 0,25 molar de ácido sulfúrico com 600 mililitros,5 molar do mesmo ácido. A molaridade da solução final é:
SIMULADO de QUÍMICA 2 os anos 2008 TODOS COLÉGIOS ) Foram misturados 400 mililitros de solução 0,25 molar de ácido sulfúrico com 600 mililitros,5 molar do mesmo ácido. A molaridade da solução final é:
QUÍMICA Exercícios de revisão resolvidos
 21. (ENEM 2011) Os refrigerantes têm-se tornado cada vez mais o alvo de políticas públicas de saúde. Os de cola apresentam ácido fosfórico, substância prejudicial à fixação de cálcio, o mineral que é o
21. (ENEM 2011) Os refrigerantes têm-se tornado cada vez mais o alvo de políticas públicas de saúde. Os de cola apresentam ácido fosfórico, substância prejudicial à fixação de cálcio, o mineral que é o
2º trimestre Sala de Estudo Química Data: 08/05/17 Ensino Médio 2º ano classe: A_B_C Profª Danusa Nome: nº
 2º trimestre Sala de Estudo Química Data: 08/05/17 Ensino Médio 2º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Termoquímica (entalpia padrão de formação) Questão 01 - (PUC RS/2017) O metano é uma
2º trimestre Sala de Estudo Química Data: 08/05/17 Ensino Médio 2º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Termoquímica (entalpia padrão de formação) Questão 01 - (PUC RS/2017) O metano é uma
PROVA DE QUÍMICA 44 PROVA DE QUÍMICA
 44 QUESTÃO 46 1 Uma certa quantidade de água é colocada em um congelador, cuja temperatura é de 20 o C. Após estar formado e em equilíbrio térmico com o congelador, o gelo é transferido para outro congelador,
44 QUESTÃO 46 1 Uma certa quantidade de água é colocada em um congelador, cuja temperatura é de 20 o C. Após estar formado e em equilíbrio térmico com o congelador, o gelo é transferido para outro congelador,
Para o estudo da densidade de alguns materiais, foram consideradas as duas amostras e a tabela abaixo. Densidade (g/cm 3, 25 o C)
 Questão 01 Para o estudo da densidade de alguns materiais, foram consideradas as duas amostras e a tabela abaixo. amostra I: um fio metálico de massa 135,00 g e volume 50,00 cm 3 amostra II: um líquido
Questão 01 Para o estudo da densidade de alguns materiais, foram consideradas as duas amostras e a tabela abaixo. amostra I: um fio metálico de massa 135,00 g e volume 50,00 cm 3 amostra II: um líquido
PROFESSOR: EQUIPE DE QUÍMICA
 PROFESSOR: EQUIPE DE QUÍMICA BANCO DE QUESTÕES - QUÍMICA ORGÂNICA 2ª SÉRIE - ENSINO MÉDIO - PARTE 2 ============================================================================================= Termoquímica
PROFESSOR: EQUIPE DE QUÍMICA BANCO DE QUESTÕES - QUÍMICA ORGÂNICA 2ª SÉRIE - ENSINO MÉDIO - PARTE 2 ============================================================================================= Termoquímica
LISTA DE EXERCÍCIO PARA A PROVA MENSAL
 Professor: Cassio Pacheco Aluno (a) Disciplia Química 1 Ano LISTA DE EXERCÍCIO PARA A PROVA MENSAL 1-. Assinale a alternativa onde você encontra somente substâncias compostas: a) H 2, P 4, H 2 O, O 2 b)
Professor: Cassio Pacheco Aluno (a) Disciplia Química 1 Ano LISTA DE EXERCÍCIO PARA A PROVA MENSAL 1-. Assinale a alternativa onde você encontra somente substâncias compostas: a) H 2, P 4, H 2 O, O 2 b)
VIII EXAME Questões Objetivas. RESPONDA AS QUESTÕES DE 1 a 30, MARCANDO UMA DAS ALTERNATIVAS DE ACORDO COM O QUE SE PEDE.
 Questões Objetivas RESPONDA AS QUESTÕES DE 1 a 30, MARCANDO UMA DAS ALTERNATIVAS DE ACORDO COM O QUE SE PEDE. Questão 01 (Peso 1) Use seus conhecimentos de estequiometria para dizer qual alternativa está
Questões Objetivas RESPONDA AS QUESTÕES DE 1 a 30, MARCANDO UMA DAS ALTERNATIVAS DE ACORDO COM O QUE SE PEDE. Questão 01 (Peso 1) Use seus conhecimentos de estequiometria para dizer qual alternativa está
VII Olimpíada Catarinense de Química Etapa I - Colégios
 VII Olimpíada Catarinense de Química 2011 Etapa I - Colégios Fonte: Chemistryland Segunda Série 1 01 200 ml de uma solução de hidróxido de alumínio são diluídos em água destilada até a sua concentração
VII Olimpíada Catarinense de Química 2011 Etapa I - Colégios Fonte: Chemistryland Segunda Série 1 01 200 ml de uma solução de hidróxido de alumínio são diluídos em água destilada até a sua concentração
XII Olimpíada Baiana de Química Exame 2017
 Questão 01 (Peso 1) Questões objetivas (QUESTÕES DE 01 A 30) A fórmula estrutural condensada, CH 3 CH 2 CH 2 COOCH 3, representa: A) um éster B) uma amida C) um aldeído D) um anidrido E) um ácido carboxílico
Questão 01 (Peso 1) Questões objetivas (QUESTÕES DE 01 A 30) A fórmula estrutural condensada, CH 3 CH 2 CH 2 COOCH 3, representa: A) um éster B) uma amida C) um aldeído D) um anidrido E) um ácido carboxílico
3º Trimestre Sala de estudos Química Data: 03/12/18 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº
 3º Trimestre Sala de estudos Química Data: 03/12/18 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº Conteúdo: FAMERP/UNIFESP (REVISÃO) Questão 01 - (FAMERP SP/2018) A tabela indica a abundância aproximada
3º Trimestre Sala de estudos Química Data: 03/12/18 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº Conteúdo: FAMERP/UNIFESP (REVISÃO) Questão 01 - (FAMERP SP/2018) A tabela indica a abundância aproximada
Atividade complementar de Química. Transformação química das substâncias. Atenção
 Atividade complementar de Química Transformação química das substâncias Educação de Jovens e Adultos Nas transformações químicas, também conhecida como reação química, as substâncias são transformadas
Atividade complementar de Química Transformação química das substâncias Educação de Jovens e Adultos Nas transformações químicas, também conhecida como reação química, as substâncias são transformadas
Instruções: Titulação: análise laboratorial de soluções. Entalpia e energia nas transformações químicas. Entalpia de ligação. Ciências da Natureza
 Ciências da Natureza Química Gabriela Rosa TRABALHO DE RECUPERAÇÃO 1ª ETAPA 1ª 10 pts 6,5 pts 18 2º A/B Instruções: Leia atentamente cada questão antes de resolvê-la. A interpretação faz parte desse trabalho.
Ciências da Natureza Química Gabriela Rosa TRABALHO DE RECUPERAÇÃO 1ª ETAPA 1ª 10 pts 6,5 pts 18 2º A/B Instruções: Leia atentamente cada questão antes de resolvê-la. A interpretação faz parte desse trabalho.
FASM MEDICINA - Segundo Semestre FACULDADE SANTA MARCELINA
 FASM 2015 - MEDICINA - Segundo Semestre FACULDADE SANTA MARCELINA 01. Certo modelo de extintor de incêndio à base de gás carbônico (CO 2), empregado na extinção de incêndios das classes B (líquidos inflamáveis)
FASM 2015 - MEDICINA - Segundo Semestre FACULDADE SANTA MARCELINA 01. Certo modelo de extintor de incêndio à base de gás carbônico (CO 2), empregado na extinção de incêndios das classes B (líquidos inflamáveis)
INSTRUÇÕES PARA A REALIZAÇÃO DA PROVA LEIA COM MUITA ATENÇÃO
 1º EM Química B Natália Av. Dissertativa 19/10/16 INSTRUÇÕES PARA A REALIZAÇÃO DA PROVA LEIA COM MUITA ATENÇÃO 1. Verifique, no cabeçalho desta prova, se seu nome, número e turma estão corretos. 2. Esta
1º EM Química B Natália Av. Dissertativa 19/10/16 INSTRUÇÕES PARA A REALIZAÇÃO DA PROVA LEIA COM MUITA ATENÇÃO 1. Verifique, no cabeçalho desta prova, se seu nome, número e turma estão corretos. 2. Esta
ROTEIRO DE ESTUDOS 1 ANO II - TRIMESTRE
 ROTEIRO DE ESTUDOS 1 ANO II - TRIMESTRE PARTE 1 SETOR A 1- Considere as seguintes informações sobre um átomo X: Um isótopo tem massa de 20 u e um contribuição de 91%; Um isótopo tem massa de 22 u e um
ROTEIRO DE ESTUDOS 1 ANO II - TRIMESTRE PARTE 1 SETOR A 1- Considere as seguintes informações sobre um átomo X: Um isótopo tem massa de 20 u e um contribuição de 91%; Um isótopo tem massa de 22 u e um
Vestibular Nacional Unicamp 1998
 Vestibular Nacional Unicamp 1998 2 ª Fase - 12 de Janeiro de 1998 Química 1 QUÍMICA ATENÇÃO: Responda às questões com letra LEGÍVEL! Isso facilitará a correção de sua prova e garantirá a compreensão de
Vestibular Nacional Unicamp 1998 2 ª Fase - 12 de Janeiro de 1998 Química 1 QUÍMICA ATENÇÃO: Responda às questões com letra LEGÍVEL! Isso facilitará a correção de sua prova e garantirá a compreensão de
UECE ª FASE COMENTÁRIO DA PROVA DE QUÍMICA
 UECE 2019.1 2ª FASE COMENTÁRIO DA PROVA DE QUÍMICA : Etoxietano Gabarito: B A substância mencionada no texto é o cloreto de sódio, cuja fórmula é NaCl e pertence a função SAL. Gabarito: A Trata-se de uma
UECE 2019.1 2ª FASE COMENTÁRIO DA PROVA DE QUÍMICA : Etoxietano Gabarito: B A substância mencionada no texto é o cloreto de sódio, cuja fórmula é NaCl e pertence a função SAL. Gabarito: A Trata-se de uma
Resolução UNIFESP 2015
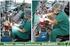 Resolução UNIFESP 2015 1-Utilizando o aparato indicado na figura, certo volume de solução aquosa de sulfato de cobre(ii) hidratado foi colocado dentro do béquer. Quando o plugue foi conectado à tomada
Resolução UNIFESP 2015 1-Utilizando o aparato indicado na figura, certo volume de solução aquosa de sulfato de cobre(ii) hidratado foi colocado dentro do béquer. Quando o plugue foi conectado à tomada
Observe a equação química que corresponde ao processo de obtenção descrito no texto.
 Utilize o texto abaixo para responder às questões de números 01 e 02. Uma das experiências realizadas em aulas práticas de Química é a obtenção do 2-cloro 2-metil propano, usualmente denominado cloreto
Utilize o texto abaixo para responder às questões de números 01 e 02. Uma das experiências realizadas em aulas práticas de Química é a obtenção do 2-cloro 2-metil propano, usualmente denominado cloreto
química caderno de prova instruções informações gerais 13/12/2009 boa prova! 2ª fase exame discursivo
 2ª fase exame discursivo 13/12/2009 química caderno de prova Este caderno, com dezesseis páginas numeradas sequencialmente, contém dez questões de Química. A Classificação Periódica dos Elementos está
2ª fase exame discursivo 13/12/2009 química caderno de prova Este caderno, com dezesseis páginas numeradas sequencialmente, contém dez questões de Química. A Classificação Periódica dos Elementos está
Química C Extensivo V. 4
 Química C Extensivo V 4 Exercícios 01) C 02) D I Errada degelo de um freezer (fusão do gelo) é um processo que absorve energia (endotérmico) II Errada A sublimação ocorre com absorção de energia (endotérmico)
Química C Extensivo V 4 Exercícios 01) C 02) D I Errada degelo de um freezer (fusão do gelo) é um processo que absorve energia (endotérmico) II Errada A sublimação ocorre com absorção de energia (endotérmico)
Atividades de Recuperação Paralela de Química A/B
 Atividades de Recuperação Paralela de Química A/B 1ª série Ensino Médio 3 Trimestre/2018 SETOR A: Conteúdo para estudos: Livro-texto 2:. Capítulo 12: Determinação de fórmulas químicas Compreender os conceitos
Atividades de Recuperação Paralela de Química A/B 1ª série Ensino Médio 3 Trimestre/2018 SETOR A: Conteúdo para estudos: Livro-texto 2:. Capítulo 12: Determinação de fórmulas químicas Compreender os conceitos
PROJETO DE RECUPERAÇÃO PARALELA 2º Trimestre
 PROJETO DE RECUPERAÇÃO PARALELA 2º Trimestre - 2017 Disciplina: Química Série: 3º ANO Ensino Médio Professor(a): Paola Araújo Objetivo: Recuperar o conteúdo referente ao 2º trimestre, mesclando conteúdos
PROJETO DE RECUPERAÇÃO PARALELA 2º Trimestre - 2017 Disciplina: Química Série: 3º ANO Ensino Médio Professor(a): Paola Araújo Objetivo: Recuperar o conteúdo referente ao 2º trimestre, mesclando conteúdos
Revisão Específicas. Química Monitores: Luciana Lima e Rafael França 02-08/11/2015. Material de Apoio para Monitoria
 Revisão Específicas 1. As conchas marinhas não se dissolvem apreciavelmente na água do mar, por serem compostas, na sua maioria, de carbonato de cálcio, um sal insolúvel cujo produto de solubilidade é
Revisão Específicas 1. As conchas marinhas não se dissolvem apreciavelmente na água do mar, por serem compostas, na sua maioria, de carbonato de cálcio, um sal insolúvel cujo produto de solubilidade é
UNIVERSIDADE ESTADUAL DE PONTA GROSSA COMISSÃO PERMANENTE DE SELEÇÃO 2 o CONCURSO VESTIBULAR DE Questões de Química
 UNIVERSIDADE ESTADUAL DE PONTA GROSSA COMISSÃO PERMANENTE DE SELEÇÃO 2 o CONCURSO VESTIBULAR DE 2011 Questões de Química 01 Sobre o modelo de Rutherford, assinale o que for correto. 01) O átomo não é maciço,
UNIVERSIDADE ESTADUAL DE PONTA GROSSA COMISSÃO PERMANENTE DE SELEÇÃO 2 o CONCURSO VESTIBULAR DE 2011 Questões de Química 01 Sobre o modelo de Rutherford, assinale o que for correto. 01) O átomo não é maciço,
2. O processo de recristalização, usado na purificação de sólidos, consiste no seguinte:
 1. O efeito estufa é um fenômeno de graves conseqüências climáticas que se deve a altas concentrações de CO no ar. Considere que, num dado período, uma indústria "contribuiu" para o efeito estufa, lançando
1. O efeito estufa é um fenômeno de graves conseqüências climáticas que se deve a altas concentrações de CO no ar. Considere que, num dado período, uma indústria "contribuiu" para o efeito estufa, lançando
