ESTRUTURA ATÔMICA OS PRIMEIROS MODELOS ATÔMICOS
|
|
|
- Rosângela Godoi Caminha
- 8 Há anos
- Visualizações:
Transcrição
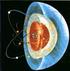
1 1 ESTRUTURA ATÔMICA OS PRIMEIROS MODELOS ATÔMICOS Alguns filosófo da Grécia Antiga já admitiam que toda e qualquer matéria seria formada por minúsculas partículas indivisíveis, que foram denominadas átomos (a palavra átomo, em grego, significa indivisível).no entanto, foi somente em 1803 que o cientista inglês John Dalton conseguiu provar cientificamente a idéia de átomo. Surgia então a teoria atômica clássica da matéria. Os principais postulados da Teoria Atômica de Dalton são: a matéria é formada por partículas extremamente pequenas chamadas átomos; os átomos são esferas maciças, indestrutíveis e intransformáveis; átomos que apresentam mesmas propriedades (tamanho, massa e forma) constituem um elemento químico; átomos de elementos diferentes possuem propriedades diferentes; os átomos podem se unir entre si formando "átomos compostos"; uma reação química nada mais é do que a união e separação de átomos. MODELO ATÔMICO DE THOMSON Em 1903, o cientista inglês Joseph J. Thomson, baseado em experiências realizadas com gases e que mostraram que a matéria era formada por cargas elétricas positivas e negativas, modificou o modelo atômico de Dalton. Segundo Thomson, o átomo seria uma esfera maciça e positiva com as cargas negativas distribuídas, ao acaso, na esfera. A quantidade de cargas positivas e negativas seriam iguais e dessa forma o átomo seria eletricamente neutro. O modelo proposto por Thomson ficou conhecido como "pudim com passas". MODELO ATÔMICO DE RUTHERFORD Em 1911, o cientista neozelandês Ernest Rutherford, utilizando os fenômenos radiativos no estudo da estrutura atômica, descobriu que o átomo não seria uma esfera maciça, mas sim formada por uma região central, chamada núcleo atômico, e uma região externa ao núcleo, chamada eletrosfera. No núcleo atômico estariam as partículas positivas, os prótons, e na eletrosfera as partículas negativas, os elétrons. Para chegar a essas conclusões Rutherford e seus colaboradores bombardearam lâminas de ouro com partículas a (2 prótons e 2 nêutrons) utilizando a aparelhagem esquematizada acima. Rutherford observou que a grande maioria das partículas atravessava normalmente a lâmina de ouro que apresentava aproximadamente 10-5 cm de espessura. Outras partículas sofriam pequenos desvios e outras, em número muito pequeno, batiam na lâmina e voltavam. O caminho seguido pelas partículas a podia ser detectado devido?s cintilações que elas provocavam no anteparo de sulfeto de zinco. Comparando o número de partículas a lançadas com o número de partículas a que sofriam desvios, Rutherford calculou que o raio do átomo deveria ser a vezes maior do que o raio do núcleo, ou seja, o átomo seria formado por espaços vazios. Por esses espaços vazios a grande maioria das partículas a atravessava a lâmina de ouro. Os desvios sofridos pelas partículas a eram devidos às repulsões elétricas entre o núcleo (positivo) e as partículas a, também positivas, que a ele se dirigiam. O modelo de Rutherford (figura ao lado) ficou conhecido como "modelo planetário".
2 2 Partículas elementares A experiência de Rutherford mostrou que no núcleo atômico além do próton deveria existir uma outra partícula. Esta foi descoberta em 1932 pelo cientista inglês James Chadwick e recebeu o nome de nêutron. Prótons, elétrons e nêutrons são as principais partículas presentes num átomo. Elas são chamadas partículas elementares ou subatômicas e suas principais características são: Partícula Massa (grama) Massa relativa Carga elétrica (Coulomb) Carga relativa Próton (p + ) 1, , Nêutron (n 0 ) 1, Elétron (e - ) 9, /1840-1, Observe que as partículas presentes no núcleo atômico apresentam a mesma massa e que essa é praticamente vezes maior do que a massa do elétron. A massa de um átomo está praticamente concentrada numa região extremamente pequena do átomo: o núcleo atômico. A quantidade atômica de prótons e elétrons presentes num átomo é a mesma, o que faz com que ele seja eletricamente neutro. MODELO ATÔMICO DE BOHR Em 1913, o físico dinamarquês Niels Bohr, ao estudar espectros de emissão de certas substâncias, modificou o modelo de Rutherford. No inicio do século XX era fato conhecido que a luz branca (luz solar, por exemplo) podia ser decomposta em diversas cores. Isso é conseguido fazendo com que a luz passe por um prisma. No caso da decomposição da luz solar obtém-se um espectro chamado espectro continuo. Este é formado por ondas eletromagnéticas visíveis e invisíveis (radiação ultravioleta e infravermelho). Na parte visível desse espectro não ocorre distinção entre as diferentes cores, mas uma gradual passagem de uma para outra. O arco-íris é um exemplo de espectro contínuo onde a luz solar é decomposta pelas gotas de água presentes na atmosfera. Como a cada onda eletromagnética está associada certa quantidade de energia, a decomposição da luz branca produz ondas eletromagnéticas com toda e qualquer quantidade de energia. No entanto, se a luz que atravessar o prisma for de uma substância como hidrogênio, sódio, neônio etc. será obtido um espectro descontínuo. Este é caracterizado por apresentar linhas coloridas separadas. Em outras palavras, somente alguns tipos de radiações luminosas são emitidas, isto é, somente radiações com valores determinados de energia são emitidas. Baseado nessas observações experimentais, Bohr elaborou um novo modelo atômico cujos postulados são: na eletrosfera os elétrons não se encontram em qualquer posição. Eles giram ao redor do núcleo em órbitas fixas e com energia definida. As órbitas são chamadas camadas eletrônicas, representadas pelas letras K, L, M, N, O, P e Q a partir do núcleo, ou níveis de energia representados pelos números 1, 2, 3, 4...;
3 3 os elétrons ao se movimentarem numa camada eletrônica não absorvem nem emitem energia; os elétrons de um átomo tendem a ocupar as camadas eletrônicas mais próximas do núcleo, isto é, as que apresentam menor quantidade de energia; um átomo está no estado fundamental quando seus elétrons ocupam as camadas menos energéticas; quando um átomo recebe energia (térmica ou elétrica), o elétron pode saltar para uma camada mais externa (mais energética). Nessas condições o átomo se torna instável. Dizemos que o átomo se encontra num estado excitado; os elétrons de um átomo excitado tendem a voltar para as camadas de origem. Quando isso ocorre, ele devolve, sob a forma de onda eletromagnética, a energia que foi recebida na forma de calor ou eletricidade. Esses postulados permitem explicar a existência dos espectros de emissão descontínuos: como o elétron só pode ocupar determinadas órbitas, as transições eletrônicas (ida e volta do elétron) ocorrem em número restrito, o que produz somente alguns tipos de radiação eletromagnética e não todas como no espectro contínuo. Modelo atômico de Bohr foi elaborado para o átomo de hidrogênio, mas aplica-se com boa aproximação a todos os outros átomos MODELO ATÔMICO ATUAL Um átomo é constituído por uma parte central chamada de núcleo, onde se encontram os prótons (partículas positivas) neutrons (partículas neutras) e uma outra parte que circunda esta parte central, chamada de eletrosfera, onde estão os elétrons (partículas negativas Estas partículas que compõe os átomos, são chamadas de fundamentais. Partícula Carga Massa Próton (p) + 1 Neutron (n) Neutro 1 Elétron (e) - A massa do elétron é 1840 vezes menor que do próton ou do neutron, por isso é desprezível. A massa do átomo está concentrada no seu núcleo.
4 4 NÚMERO DE MASSA (A) Exemplos: Representação: A X símbolo 14 N 56 Fe Um átomo é neutro ou seja, o número de cargas positivas (prótons) é igual ao número de cargas negativas (elétrons). nº prótons O átomo de oxigênio tem 8 prótons, portanto 8 elétrons. O átomo de hidrogênio tem 1 próton, portanto 1 elétron. NÚMERO ATÔMICO (Z) É o número de prótons (carga nuclear), o número atômico identifica o átomo que estamos trabahando. Z = n p Se um átomo tem número de atômico 6, é o carbono, apresenta 6 prótons. Se um um átomo tem número atômico 13, é o aluminio, apresenta 13 prótons. Portanto temos: Z = nº p Representação: Com estas informações, conseguimos determinar a quantidade de cada partícula fundamental. Veja alguns exemplos: Observe que no exemplo acima o número atômico igual a 1, determina o hidrogênio, mas a massa de cada hidrogênio e diferente. O símbolo representa o elemento químico, conjunto de átomos de mesmo número atômico. O número atômico define o elemento químico.
5 5 Quando falamos no urânio, o número atômico é 92, sempre. Mas temos na natureza átomos de urânio com diferentes massas, por exemplo: Estes átomos com mesmo número atômico e diferente número de nêutrons, chamamos de isótopos. ISÓTOPO DO URÂNIO 235 ISÓTOPO DO URÂNIO Se é urânio, o número atômico é 92, o número que acompanha o nome do elemento é a sua massa. O acidente nuclear que aconteceu em Goiânia, no mês de setembro de 1987, foi causado pelo césio - 137, ou seja, isótopo do césio de massa 137. No exemplo que colocamos anteriormente do hidrogênio, temos: Na natureza, a maior parte ( quase a totalidade ) dos átomos de hidrogênio, apresentam massa igual a 1, uma pequena parte apresentam massa a 2 e uma outra parte, apenas residual, portanto, desprezível, apresenta massa 3. A molécula de água, é formada por dois átomos de hidrogênio e um de oxigênio. Quando falamos em água pesada, estamos nos referindo a moléculas de água formadas por átomos de hidrogênio mais pesados, essencialmente de deutério (hidrogênio de massa = 2). 1 H 2 O maior parte das moléculas de água. 2 H 2 O água pesada. A água pesada pode ser representada por D 2 O (D = Deutério) ISÓBAROS São átomos que apresentam o mesmo número de massa, porém não faz parte do mesmo elemento químico, ou seja, apresenta número atômico diferente. Mesma massa nº atômico e número de neutrons diferentes, são isóbaros. ISÓTONOS São átomos que apresentam a semelhança no número de neutrons, ou seja, a massa e o número atômico são diferentes.
6 6 Resumindo: PRÓTONS MASSA NEUTRONS ISÓTOPOS ISÓBAROS ISÓTONOS Representando os elementos hipoteticamente por: ISÓBAROS = A e B (mesma massa ISÓTOPOS = B e D, C e E (mesmo n de prótons) ISÓTONOS = A, C e D, B e E (mesmo n de neutrons) Quais átomos devem ser representados pelo mesmo símboo? Aqueles que fazem parte do mesmo elemento químico, ou seja, que apresentam o mesmo número atômico (isótopos), portanto, B e D, C e E. ÍONS Como já vimos, os átomos são formados por um núcleo (parte central) e a eletrosfera (parte periférica). O núcleo, apesar de concentrar praticamente toda a massa do átomo, apresenta um diâmetro cerca de vezes menor do que o átomo. Se o átomo fosse o maracanã, o núcleo seria a bola, no centro do campo. Se o átomo tivesse um diâmetro de 100m seu núcleo teria diâmetro de 1cm. Os átomos sofrem reações para alcançar uma estabilidade. Estas reações ocorrem através de choques, e como o núcleo está protegido, não participa delas. As alterações sofridas por um átomo, ocorrem na eletrosfera, ou seja nos elétrons. Os átomos, para alcançarem a estabilidade, podem perder ou ganhar elétrons, com isso adquirem cargas. Estas espécies, carregadas positivamente ou negativamente, chamamos de íons. Vamos ver alguns casos: ÁTOMO ELETRIZADO POSITIVAMENTE (cátion) O átomo eletrizado positivamente, é aquele que apresenta mais cargas positivas (prótons), do que cargas negativas (elétrons). Para tanto, ele perdeu elétrons. O total de elétrons perdidos é o total de cargas positivas adquiridas. Exemplos:
7 7 ÁTOMO ELETRIZADO NEGATIVAMENTE ( ânion ) O átomo eletrizado negativamente, apresenta mais elétrons do que prótons. Para tanto ele ganhou elétrons. O total de elétrons ganhos é o total de cargas negativas adquiridas. Exemplos : Resumindo: ÍONS É importante frizar, toda e quaquer ateração no átomo ocorre nos elétrons, os prótons e neutrons permanecem inalterados. A única diferença entre estas espécies químicas está no número de elétrons. VALÊNCIA É o número de ligações que um átomo faz. Como em cada ligação está envolvido 1 elétron deste átomo, o total de cargas adquiridas, positiva ou negativa, determina sua valência. Al 3+ Valência 3 O 2- Valência 2 Na + Valência 1 Já sabemos: trivalente bivalente monovalente CÁTION CARGA POSITIVA ÂNION CARGA NEGATIVA VALÊNCIA TOTAL EM CARGAS ENTÃO, QUANDO DIZEMOS: REPRESENTAMOS - O potássio forma cátion monovalente K + - O alumínio forma cátion trivalente Al 3+ - O cloro forma ânion monovalente Cl - - O oxigênio forma ânion bivalente O 2- Outro termo comum: Espécies isoeletrônicas apresentam o mesmo número de elétrons. Exemplos:
8 8
9 9 Organização Educacional Margarida Maria Nome Nº 3ª A/B EM 19/10/09 Exercícios sobre Atomística 1) Somando-se todas as partículas (prótons, nêutrons e elétrons) de um átomo de 28 Ni 59 com as do átomo de 80 Hg 201, o total de partículas será: a) 281. b) 158. c) 368. d) 108. e) ) O átomo de telúrio (Te) possui 52 elétrons e 75 nêutrons. O seu número atômico, número de massa e número de elétrons da camada de valência são, respectivamente: a) 52, 127 e 5. b) 52, 127 e 6. c) 127, 52 e 6. d) 52, 75 e 5. e) 52, 127 e 4. 3) Um elemento tem número de massa atômica (3x + 6), onde x é seu número atômico. O número nêutrons desse elemento será dado por: a) 2x + 2. b) 2x + 3. c) 2x + 6. d) x + 6. e) x ) (UERJ) Um sistema é formado por partículas que apresentam composição atômica: 10 prótons, 10 elétrons e 11 nêutrons. A ele foram adicionadas novas partículas. O sistema resultante será quimicamente puro se as partículas adicionadas apresentarem a seguinte composição atômica: a) 21 prótons, 10 elétrons e 11 nêutrons. b) 20 prótons, 20 elétrons e 22 nêutrons. c) 10 prótons, 10 elétrons e 12 nêutrons. d) 11 prótons, 11 elétrons e 12 nêutrons. e) 11 prótons, 11 elétrons e 11 nêutrons. 5) (Covest-2003)Isótopos radiativos são empregados no diagnóstico e tratamento de inúmeras doenças. Qual é a principal propriedade que caracteriza um elemento químico? a) Número de massa b) Número de prótons c) Número de nêutrons d) Energia de ionização e) Diferença entre o número de prótons e de nêutrons 6) (UCS-RS) O conhecimento das partículas subatômicas, bem como do seu número, é útil para a compreensão das propriedades individuais dos átomos. Os átomos distinguem-se uns dos outros pelo número de prótons e de nêutrons que contêm. Com relação ao átomo de boro ( 5 B 11 ), é correto afirmar que ele distingue dos demais átomos por possuir... a) 5 prótons e 6 nêutrons. b) O número atômico e o número de nêutrons iguais a 6. c) O número atômico e o número de nêutrons iguais a 5. d) Número igual de prótons e nêutrons. e) 11 prótons e 5 nêutrons. 7) Com relação às características do átomo e ao conceito de elemento químico, assinale a afirmação correta: a) Um elemento químico é caracterizado pelo número de massa. b) Os átomos de um mesmo elemento químico obrigatoriamente devem apresentar o mesmo número de nêutrons. c) Na eletrosfera, região que determina a massa do átomo, encontram-se os elétrons. d) O número de massa é a soma do número de prótons com o número de elétrons. e) Um elemento químico é constituído de átomos de mesma carga nuclear. 8) (CEFET-SP) Um átomo genérico X apresenta a seguinte estrutura: Prótons 13 Nêutrons 14 Elétrons 13 O número de massa deste átomo é igual a: a) 13. b) 14. c) 26. d) 27. e) 40. 9) O número atômico, número de massa e número de nêutrons de um átomo são expressos, respectivamente por (3x + 5), (8x) e (6x 30). Determine os números de prótons e nêutrons desse átomo
10 10 10) (Covest-90) Preencha as lacunas da seguinte tabela: Elemento Nº de prótons Nº de elétrons no átomo Nº de nêutrons Nº de massa neutro Th Cl Lendo da esquerda para a direita, formar-se-á, com os números inseridos, a seguinte seqüência numérica: a) 90, 142, 17, 36. b) 142, 90, 19, 36. c) 142, 90, 36, 17. d) 90, 142, 36, 17. e) 89, 152, 7, ) Quando se compara o átomo neutro do enxofre com o íon sulfeto (S 2 ), verifica-se que o segundo possui: a) Um elétron a mais e mesmo número de nêutrons. b) Dois nêutrons a mais e mesmo número de elétrons. c) Um elétron a mais e mesmo número de prótons. d) Dois elétrons a mais e mesmo número de prótons. e) Dois prótons a mais e mesmo número de elétrons. 12) (Covest-2002) Isótopos radiativos de iodo são utilizados no diagnóstico e tratamento de problemas da tireóide, e são, em geral, ministrados na forma de sais de iodeto. O número de prótons, nêutrons e elétrons no isótopo 131 do iodeto são, respectivamente: a) 53, 78 e 52. b) 53, 78 e 54. c) 53, 131 e 53. d) 131, 53 e 131. e) 52, 78 e ) (UFPA) Recentemente o Departamento de Química da UFPA adquiriu um equipamento de ressonância magnética nuclear. Este equipamento tem como finalidade à análise de estruturas moleculares, e para a sua operação é necessária a utilização de solventes deuterados, tais como D 2 O, CDCl 3, MeOD e outros. O átomo de deutério em relação ao átomo de hidrogênio é um: a) Isóbaro. b) Isótopo. c) Isótono. d) Alótropo. e) Derivado radioativo. 14) (ITA-SP) Dados os nuclídeos 15 I 30, 18 II 30, 13 III 30, 15 IV 30, 18 V 29, 14 VI 31, podemos afirmar que: a) I e IV são isótopos; II e V são isóbaros; III e IV são isoneutrônicos. b) IV e VI são isótopos; I, II e III são isóbaros; V e VI são isoneutrônicos. c) I, II e III são isótopos; III e V são isóbaros; IV e VI são isoneutrônicos. d) II e VI são isótopos; I e IV são isóbaros; III e VI são isoneutrônicos. e) II e V são isótopos; III e IV são isóbaros; III e VI são isoneutrônicos. 15) (UFV-MG) Considerando-se os elementos X, Y e Z e sabendo-se que eles apresentam as seguintes características: X tem n prótons, n elétrons e n nêutrons. Y tem n 1 prótons, n 1 elétrons e n nêutrons. Z tem n + 1 prótons, n + 1 elétrons e n + 2 nêutrons. Podemos afirmar que: a) Y e Z são isótopos. b) Y torna-se isótopo de Z quando ganha 1 próton e 1 elétron. c) Y e Z são isótonos. d) X torna-se isótopo de Z quando ganha 1 próton e 1 elétron. e) Z torna-se isótopo de Y quando ganha 2 elétrons e 1 próton. 16) O átomo mais abundante do alumínio é o 13 Al 27. Os números de prótons, nêutrons e elétrons do íon Al 3+ deste isótopo são, respectivamente: a) 13, 14 e 10. b) 13, 14 e 13. c) 10, 14 e 13. d) 16, 14 e 10. e) 10, 40 e ) Dois átomos A e B são isóbaros. O átomo A tem número de massa (4x + 5) e número atômico (2x + 2) e B tem número de massa (5x 1). O número atômico, número de massa, número de nêutrons e número de elétrons do átomo A correspondem, respectivamente, a: a) 10, 29, 14 e 15. b) 29, 15, 14 e 15. c) 29, 15, 15 e 14. d) 14, 29, 15 e 14. e) 29, 14, 15 e ) A substância química bromo é formada por moléculas biatômicas (Br 2 ) com massas moléculas 158, 160 e 162 e, somente essas. Com essa informação podemos concluir que o elemento bromo é formado pelos isótopos: a) 79 Br, 80 Br e 81 Br. b) 79 Br e 81 Br, apenas. c) 79 Br e 80 Br, apenas. d) 80 Br e 81 Br, apenas. e) 158 Br, 160 Br e 162 Br.
11 11 19) O número de elétrons do cátion X 3+ é igual ao número de prótons do átomo Y, que por sua vez é isótopo do átomo W, que apresenta número atômico e número de massa, respectivamente, 36 e 84. O número atômico do elemento X é: a) 33. b) 36. c) 39 d) 45. e) ) Num exercício escolar, um professor pediu a seus alunos que imaginassem um átomo que tivesse o número atômico igual ao seu número de chamada e o número de nêutrons 2 unidades a mais que o número de prótons. O aluno de número 15 esqueceu de somar 2 para obter o número de nêutrons e, conseqüentemente, dois alunos imaginaram átomos isóbaros. Isso ocorreu com os alunos de números de chamadas: a) 14 e 15. b) 13 e 15. c) 15 e 16. d) 12 e 15. e) 15 e ) Um átomo do elemento químico X é isótopo de 20 A 41 e isóbaro de 22 B 44. Com base nessas informações, podemos concluir que o átomo do elemento X possui: a) 22 prótons. b) 24 nêutrons. c) 20 nêutrons. d) Número de massa igual a 61. e) Número de massa igual a 41 22) Alguns elementos apresentam, no seu estado fundamental e no seu nível mais energético, a distribuição eletrônica np x. Dentre os elementos abaixo, o que apresenta o maior valor de x é: a) 13Al. b) 14Si. c) 34Se d) 15P. e) 35Br. 23) Um elemento cujo átomo possui 20 nêutrons apresenta distribuição eletrônica no estado fundamental 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1, tem: a) Número atômico 20 e número de massa 39. b) Número atômico 39 e número de massa 20. c) Número atômico 19 e número de massa 20. d) Número atômico 19 e número de massa 39. e) Número atômico 39 e número de massa ) Os implantes dentários estão mais seguros no Brasil e já atendem às normas internacionais de qualidade. O grande salto de qualidade aconteceu no processo de confecção dos parafusos e pinos de titânio que compõem as próteses. Feitas com ligas de titânio, essas próteses são usadas para fixar coroas dentárias, aparelhos ortodônticos e dentaduras nos ossos da mandíbula e do maxilar. Considerando que o número atômico do titânio é 22, sua configuração eletrônica será: a) 1s 2 2s 2 2p 6 3s 2 3p 3. b) 1s 2 2s 2 2p 6 3s 2 3p 5. c) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2. d) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2. e) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6. 25) O bromo, único halogênios que nas condições ambiente se encontra no estado líquido, formado por átomos representados por 35 Br 80, apresenta: a) 25 elétrons na camada de valência. b) 2 elétrons na camada de valência. c) 7 elétrons na camada de valência. d) 35 partículas nucleares. e) 45 partículas nucleares. 26) As soluções aquosas de alguns sais são coloridas, tais como: Solução aquosa de CuSO 4 = azul. Solução aquosa de NiSO 4 = verde. Solução aquosa de KMnO 4 = violeta. A coloração dessas soluções pode ser relacionada à presença de um elemento de transição. Sabendo que estes elementos apresentam seu elétron mais energético situado no subnível d, qual dos elementos abaixo apresenta o maior número de elétrons no subnível d? a) 11Na. b) 17Cl. c) 20Ca. d) 21Sc. e) 26Fe. 27) O cloreto de sódio (NaCl) representa papel importante na fisiologia da pessoa, pois atua como gerador do ácido clorídrico no estômago. Com relação ao elemento químico cloro (Z = 17), o número de elétrons no subnível p é: a) 8. b) 12. c) 11. d) 10. e) 6. 28) (UEL-PR) Um estudante apresentou a seguinte distribuição eletrônica para o átomo de bromo (Z = 35): 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 9 4p 6 Houve incorreção no número de elétrons dos subníveis: a) 3d e 4p. b) 3d e 4s. c) 4s e 4p. d) 3d, somente. e) 4p, somente. 29) O titânio (Z = 22) é metal usado na fabricação de motores de avião e de pinos para próteses. Quantos elétrons há no último nível da configuração eletrônica desse metal?
12 12 a) 6. b) 5. c) 4. d) 3. e) 2. 30) (PUCCAMP-SP) A corrosão de materiais de ferro envolve a transformação de átomos do metal em íons (ferroso ou férrico). Quantos elétrons há no terceiro nível energético do átomo neutro de ferro? a) 2. b) 6. c) 14. d) 16. e) ) (CESGRANRIO) Alguns elementos apresentam, no estado fundamental e no seu nível mais energético, a configuração np x. Dentre os elementos abaixo, o que apresenta maior valor de x é: a) Al (Z = 13). b) F (Z = 9). c) Si (Z = 14). d) N (Z = 7). e) Ne (Z = 10). 32) (UNISA-SP) A configuração eletrônica do elemento químico de número 21 é: a) 2, 8, 9, 2. b) 2, 8, 8, 3. c) 2, 8, 10, 1. d) 2, 18, 1. e) 2, 8, 7, 4. 33) A configuração eletrônica de um átomo neutro no estado fundamental é 1s 2 2s 2 2p 6 3s 2 3p 5. O número de orbitais vazios remanescentes no nível principal M é: a) 0. b) 1. c) 5. d) 6. e) ) No esquema a seguir temos duas configurações eletrônicas de um mesmo átomo neutro: I) 1s 2 2s 2 II) 1s 2 2s 1 2p 1 Indique a alternativa correta: a) I é uma configuração ativada. b) II é uma configuração fundamental. c) I é gás nobre. d) A passagem de I para II absorve energia. e) A passagem de I para II liberta energia na forma de ondas eletromagnéticas. 35) Beber refrigerante em excesso é um risco a saúde dos ossos. A ingestão de mais de quatro latas de 350 ml desta bebida por dia leva o organismo a perder cálcio e fósforo, elementos importantes para uma ossatura forte. No estudo desse assunto é fundamental o conhecimento da configuração eletrônica dos átomos de cálcio e fósforo e de seus íons. Indique a alternativa correta: Dados: Ca (Z = 20 e A = 40); P (Z = 15 e A = 31) a) O número de prótons do íon Ca 2+ é 22. b) O átomo neutro de fósforo é isoeletrônico do íon S 1. c) O fósforo apresenta número atômico 9. d) O íon Ca 2+ é formado pelo ganho de 2 elétrons a partir do átomo neutro. e) O átomo neutro de fósforo em seu estado fundamental apresenta três elétrons desemparelhados. 36) (UFRS) Considerando os orbitais 2p e 3p de um mesmo átomo, podemos afirmar que os mesmos possuem: a) Igual energia. b) Mesma simetria. c) Iguais diâmetros. d) Mesma capacidade de ligação. e) Mesmos números quânticos. 37) O último elétron distribuído na configuração eletrônica de um átomo neutro, no estado fundamental, possui o seguinte conjunto de números quânticos: 4, 1, +1 e +1/2. Sabendo-se que esse átomo possui número de massa igual a 84 e que, por convenção, o primeiro elétron a ocupar um orbital possui número quântico de spin igual a 1/2, o número de nêutrons existentes no núcleo desse átomo é: a) 48. b) 84. c) 36. d) 45. e) ) (UDESC) Considere a configuração eletrônica do neônio a seguir 1s 2 2s 2 2p 6. Os números quânticos principal, secundário, magnético e spin, do elétron mais energético são, respectivamente: a) 2, 1, 1, + 1/2. b) 2, 1, + 1, + 1/2. c) 1, 0, 0, 1/2. d) 1, 1 +1, + 1/2. e) 1, 0, 0, +1/2. 39) O subnível mais energético do átomo de um elemento apresenta os seguintes números quânticos principal, secundário e magnético, respectivamente 3, 2 e 0. O número atômico deste elemento é, no máximo, igual a: a) 24. b) 25. c) 26. d) 27. e) ) Qual o número de elétrons na eletrosfera de um determinado átomo que tem os seguintes números quânticos para o seu último elétron? Principal = 3. Secundário = 1. Magnético = 0. a) 10. b) 12. c) 14. d) 16. e) 18.
13 13 Respostas : atomística 1- C 2- A 3- C 4- C 5- B 6- A 7- E 8- D 9- P=80 e n= A 11- D 12- B 13- B 14- D 15- D 16- B 17- D 18- A 19- C 20- A 21- B 22- E 23- D 24- D 25- C 26- E 27- C 28- A 29- E 30- C 31- E 32- A 33- C 34- D 35- E 36- B 37- A 38- B 39- E 40- C
Química Atomística Profª: Bruna Villas Bôas. Exercícios
 NÚMERO ATÔMICO (Z) Os diferentes tipos de átomos (elementos químicos) são identificados pela quantidade de prótons (P) que possui. Esta quantidade de prótons recebe o nome de número atômico e é representado
NÚMERO ATÔMICO (Z) Os diferentes tipos de átomos (elementos químicos) são identificados pela quantidade de prótons (P) que possui. Esta quantidade de prótons recebe o nome de número atômico e é representado
Próton Nêutron Elétron
 Próton Nêutron Elétron ARNOLD SOMMERFELD MODELO ATÔMICO DE ARNOLD SOMMERFELD - 1916 Ao pesquisar o átomo, Sommerfeld concluiu que os elétrons de um mesmo nível, ocupam órbitas de trajetórias diferentes
Próton Nêutron Elétron ARNOLD SOMMERFELD MODELO ATÔMICO DE ARNOLD SOMMERFELD - 1916 Ao pesquisar o átomo, Sommerfeld concluiu que os elétrons de um mesmo nível, ocupam órbitas de trajetórias diferentes
Thomson denominou este segundo modelo atômico de Pudim de Passas.
 EVOLUÇÃO DOS MODELOS ATÔMICOS Durante algum tempo a curiosidade do que era constituída a matéria parecia ser impossível de ser desvendada. Até que em 450 a.c. o filósofo grego Leucipo de Mileto afirmava
EVOLUÇÃO DOS MODELOS ATÔMICOS Durante algum tempo a curiosidade do que era constituída a matéria parecia ser impossível de ser desvendada. Até que em 450 a.c. o filósofo grego Leucipo de Mileto afirmava
Próton Nêutron Elétron
 Próton Nêutron Elétron Próton Nêutron Elétron Número de prótons: 54 2 Nome do elemento: BORO BERÍLIO HÉLIO Esta Os quantidade diferentes tipos de prótons de átomos recebe (elementos o nome químicos) de
Próton Nêutron Elétron Próton Nêutron Elétron Número de prótons: 54 2 Nome do elemento: BORO BERÍLIO HÉLIO Esta Os quantidade diferentes tipos de prótons de átomos recebe (elementos o nome químicos) de
Material Extra: Modelos atômicos e atomística Química professor Cicero # Modelos Atômicos e atomística - Palavras chaves
 Material Extra: Modelos atômicos e atomística Química professor Cicero # Modelos Atômicos e atomística - Palavras chaves Evolução da ideia do átomo 1) Partícula maciça, indivisível e indestrutível; 2)
Material Extra: Modelos atômicos e atomística Química professor Cicero # Modelos Atômicos e atomística - Palavras chaves Evolução da ideia do átomo 1) Partícula maciça, indivisível e indestrutível; 2)
ESPECTRO ELETROMAGNÉTICO
 COLÉGIO ESTADUAL RAINHA DA PAZ, ENSINO MÉDIO REPOSIÇÃO DAS AULAS DO DIA 02 e 03/07/2012 DAS 1 ª SÉRIES: A,B,C,D,E e F. Professor MSc. Elaine Sugauara Disciplina de Química ESPECTRO ELETROMAGNÉTICO As ondas
COLÉGIO ESTADUAL RAINHA DA PAZ, ENSINO MÉDIO REPOSIÇÃO DAS AULAS DO DIA 02 e 03/07/2012 DAS 1 ª SÉRIES: A,B,C,D,E e F. Professor MSc. Elaine Sugauara Disciplina de Química ESPECTRO ELETROMAGNÉTICO As ondas
OPÇÃO CONCURSO. e) 11 prótons, 11 elétrons e 11 nêutrons.
 1) Somando-se todas as partículas (prótons, nêutrons e elétrons) de um átomo de 28 Ni 59 com as do átomo de 80 Hg 201, o total de partículas será: a) 281. b) 158. c) 368. d) 108. e) 360. 2) O átomo de
1) Somando-se todas as partículas (prótons, nêutrons e elétrons) de um átomo de 28 Ni 59 com as do átomo de 80 Hg 201, o total de partículas será: a) 281. b) 158. c) 368. d) 108. e) 360. 2) O átomo de
1º trimestre Ciências Sala de estudos Data: Abril/2015 Ensino Fundamental 9º ano classe: Profª Elisete Nome: nº
 1º trimestre Ciências Sala de estudos Data: Abril/2015 Ensino Fundamental 9º ano classe: Profª Elisete Nome: nº Valor: 10 Nota:.. Conteúdo: Atomística e MRU 1) Observe o trecho da história em quadrinhos
1º trimestre Ciências Sala de estudos Data: Abril/2015 Ensino Fundamental 9º ano classe: Profª Elisete Nome: nº Valor: 10 Nota:.. Conteúdo: Atomística e MRU 1) Observe o trecho da história em quadrinhos
478 a.c. Leucipo e seu discípulo Demócrito
 MODELOS ATÔMICOS 478 a.c. Leucipo e seu discípulo Demócrito - A matéria após sofrer várias subdivisões, chegaria a uma partícula indivisível a que chamaram de átomo. - ÁTOMO a = sem tomos = divisão - Esta
MODELOS ATÔMICOS 478 a.c. Leucipo e seu discípulo Demócrito - A matéria após sofrer várias subdivisões, chegaria a uma partícula indivisível a que chamaram de átomo. - ÁTOMO a = sem tomos = divisão - Esta
Resoluções das Atividades
 Resoluções das Atividades Sumário Módulo 1 Teoria atômica básica e leis ponderais Evolução dos modelos atômicos Modelo atômico atual 1 Módulo 2 Números quânticos; Distribuição eletrônica Paramagnetismo,
Resoluções das Atividades Sumário Módulo 1 Teoria atômica básica e leis ponderais Evolução dos modelos atômicos Modelo atômico atual 1 Módulo 2 Números quânticos; Distribuição eletrônica Paramagnetismo,
Teoria Atômica. Constituição da matéria. Raízes históricas da composição da matéria. Modelos atômicos. Composição de um átomo.
 Teoria Atômica Constituição da matéria Raízes históricas da composição da matéria Modelos atômicos Composição de um átomo Tabela periódica Raízes Históricas 6000 a.c.: descoberta do fogo 4000 a.c.: vidros,
Teoria Atômica Constituição da matéria Raízes históricas da composição da matéria Modelos atômicos Composição de um átomo Tabela periódica Raízes Históricas 6000 a.c.: descoberta do fogo 4000 a.c.: vidros,
Prova de Recuperação Bimestral de Ciências Nome Completo: Data: / /2010
 COLÉGIO MARIA IMACULADA QI 05 ch. 72 LAGO SUL BRASÍLIA DF E-MAIL: cmidf@cmidf.com.br FONE: 248 4768 SITE: www.cmidf.com.br VALOR:10 pontos. NOTA: 9ºano 2º PERÍODO Prova de Recuperação Bimestral de Ciências
COLÉGIO MARIA IMACULADA QI 05 ch. 72 LAGO SUL BRASÍLIA DF E-MAIL: cmidf@cmidf.com.br FONE: 248 4768 SITE: www.cmidf.com.br VALOR:10 pontos. NOTA: 9ºano 2º PERÍODO Prova de Recuperação Bimestral de Ciências
Goiânia, / / 2014. Elemento Configuração 1 1s 2 2s 2 2p 6 3s 1 2 1s 2 2s 2 2p 4 3 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 4 1s 2 2s 2 2p 6 3s 2 3p 6
 Lista de exercícios - Química Aluno (a): Nº. Professora: Núbia de Andrade Série: 1º ano (Ensino médio) Turma: Goiânia, / / 2014. Questão 01) Localize na Tabela Periódica o elemento químico de número atômico
Lista de exercícios - Química Aluno (a): Nº. Professora: Núbia de Andrade Série: 1º ano (Ensino médio) Turma: Goiânia, / / 2014. Questão 01) Localize na Tabela Periódica o elemento químico de número atômico
O Átomo. a + thomos = sem divisão
 O Átomo 1. O nome átomo tem origem na Grécia Antiga no sec. V a.c. Os pensadores antigos falavam da existência de partículas invisíveis e indivisíveis que formariam toda matéria. a + thomos = sem divisão
O Átomo 1. O nome átomo tem origem na Grécia Antiga no sec. V a.c. Os pensadores antigos falavam da existência de partículas invisíveis e indivisíveis que formariam toda matéria. a + thomos = sem divisão
Exercícios de Revisão de Química 1º ano
 Questão 01) Dentre as alternativas abaixo, indicar a que contém a afirmação correta. a) Dois átomos que possuem o mesmo número de nêutrons pertencem ao mesmo elemento químico. b) Dois átomos com o mesmo
Questão 01) Dentre as alternativas abaixo, indicar a que contém a afirmação correta. a) Dois átomos que possuem o mesmo número de nêutrons pertencem ao mesmo elemento químico. b) Dois átomos com o mesmo
MODELOS ATÔMICOS. Química Professora: Raquel Malta 3ª série Ensino Médio
 MODELOS ATÔMICOS Química Professora: Raquel Malta 3ª série Ensino Médio PRIMEIRA IDEIA DO ÁTOMO 546 a.c. Tales de Mileto: propriedade da atração e repulsão de objetos após atrito; 500 a.c. Empédocles:
MODELOS ATÔMICOS Química Professora: Raquel Malta 3ª série Ensino Médio PRIMEIRA IDEIA DO ÁTOMO 546 a.c. Tales de Mileto: propriedade da atração e repulsão de objetos após atrito; 500 a.c. Empédocles:
Escola Secundária Anselmo de Andrade Teste Sumativo de Ciências Físico - Químicas 9º Ano Ano Lectivo 08/09
 Escola Secundária Anselmo de Andrade Teste Sumativo de Ciências Físico - Químicas 9º Ano Ano Lectivo 08/09 2ºTeste Sumativo 1ºPeríodo Duração do Teste:60 minutos Data: 05 / 12 / 08 Prof. Dulce Godinho
Escola Secundária Anselmo de Andrade Teste Sumativo de Ciências Físico - Químicas 9º Ano Ano Lectivo 08/09 2ºTeste Sumativo 1ºPeríodo Duração do Teste:60 minutos Data: 05 / 12 / 08 Prof. Dulce Godinho
DISTRIBUIÇÃO ELETRÔNICA E N OS QUâNTICOS TEORIA - PARTE II. Elétron de diferenciação e elétrons de valência. Distribuição eletrônica de íons
 DISTRIBUIÇÃO ELETRÔNICA E N OS QUâNTICOS TEORIA - PARTE II Elétron de diferenciação e elétrons de valência O elétron de diferenciação é definido como o último elétron do subnível mais energético de um
DISTRIBUIÇÃO ELETRÔNICA E N OS QUâNTICOS TEORIA - PARTE II Elétron de diferenciação e elétrons de valência O elétron de diferenciação é definido como o último elétron do subnível mais energético de um
Química A Intensivo V. 1
 1 Química A Intensivo V. 1 Exercícios 01) 10 01. Incorreta. O modelo atômico de Dalton não prevê a existência de elétrons. 02. Correta. Segundo Dalton, os átomos eram indestrutíveis e, durante uma reação
1 Química A Intensivo V. 1 Exercícios 01) 10 01. Incorreta. O modelo atômico de Dalton não prevê a existência de elétrons. 02. Correta. Segundo Dalton, os átomos eram indestrutíveis e, durante uma reação
Evolução do Modelo Atómico
 Evolução do Modelo Atómico Desde a antiguidade que os homens se preocupavam em saber de que é que as «coisas» são feitas. No entanto, existiam perspectivas diversas sobre o assunto, a mais conhecida das
Evolução do Modelo Atómico Desde a antiguidade que os homens se preocupavam em saber de que é que as «coisas» são feitas. No entanto, existiam perspectivas diversas sobre o assunto, a mais conhecida das
Lista exercícios N1 Química Geral Tabela Periódica, distribuição eletrônica e ligações químicas.
 1 Parte I - Considere as informações abaixo: Lista exercícios N1 Química Geral Tabela Periódica, distribuição eletrônica e ligações químicas. Núcleo: Prótons e nêutrons. Eletrosfera: elétrons Os átomos
1 Parte I - Considere as informações abaixo: Lista exercícios N1 Química Geral Tabela Periódica, distribuição eletrônica e ligações químicas. Núcleo: Prótons e nêutrons. Eletrosfera: elétrons Os átomos
Adaptado de Professora: Miwa Yoshida. www.colegionobel.com.br/2004quimica1oano/atomo.ppt
 Adaptado de Professora: Miwa Yoshida www.colegionobel.com.br/2004quimica1oano/atomo.ppt Leucipo de Mileto ( 440 a.c.) & Demócrito (460 a.c. - 370 a.c. ) A ideia de dividirmos uma porção qualquer de matéria
Adaptado de Professora: Miwa Yoshida www.colegionobel.com.br/2004quimica1oano/atomo.ppt Leucipo de Mileto ( 440 a.c.) & Demócrito (460 a.c. - 370 a.c. ) A ideia de dividirmos uma porção qualquer de matéria
CLASSIFICAÇÃO PERIÓDICA DOS ELEMENTOS
 CLASSIFICAÇÃO PERIÓDICA DOS ELEMENTOS EXERCÍCIOS Questão 01) O correto uso da tabela periódica permite determinar os elementos químicos a partir de algumas de suas características. Recorra a tabela periódica
CLASSIFICAÇÃO PERIÓDICA DOS ELEMENTOS EXERCÍCIOS Questão 01) O correto uso da tabela periódica permite determinar os elementos químicos a partir de algumas de suas características. Recorra a tabela periódica
Modelos atômicos. A origem da palavra átomo
 Modelos???? Modelos atômicos A origem da palavra átomo A palavra átomo foi utilizada pela primeira vez na Grécia antiga, por volta de 400 ac. Demócrito (um filósofo grego) acreditava que todo tipo de matéria
Modelos???? Modelos atômicos A origem da palavra átomo A palavra átomo foi utilizada pela primeira vez na Grécia antiga, por volta de 400 ac. Demócrito (um filósofo grego) acreditava que todo tipo de matéria
Segundo a Portaria do Ministério da Saúde MS n.o 1.469, de 29 de dezembro de 2000, o valor máximo permitido (VMP) da concentração do íon sulfato (SO 2
 11 Segundo a Portaria do Ministério da Saúde MS n.o 1.469, de 29 de dezembro de 2000, o valor máximo permitido (VMP) da concentração do íon sulfato (SO 2 4 ), para que a água esteja em conformidade com
11 Segundo a Portaria do Ministério da Saúde MS n.o 1.469, de 29 de dezembro de 2000, o valor máximo permitido (VMP) da concentração do íon sulfato (SO 2 4 ), para que a água esteja em conformidade com
Estão corretos: a) apenas I, II e V. b) apenas I, III e IV. c) apenas II, III e V. d) I, II, III, IV e V. e) apenas I, II, III, IV.
 1. (Ufpr 2014) As teorias atômicas vêm se desenvolvendo ao longo da história. Até o início do século XIX, não se tinha um modelo claro da constituição da matéria. De lá até a atualidade, a ideia de como
1. (Ufpr 2014) As teorias atômicas vêm se desenvolvendo ao longo da história. Até o início do século XIX, não se tinha um modelo claro da constituição da matéria. De lá até a atualidade, a ideia de como
MODELO ATÔMICO ATUAL
 MODELO ATÔMICO ATUAL Portal de Estudos em Química (PEQ) www.profpc.com.br Página 1 EXERCÍCIOS DE APLICAÇÃO 01 (CESGRANRIO-RJ) A distribuição eletrônica do átomo 56 26 Fe, em camadas é: a) 1s 2 2s 2 2p
MODELO ATÔMICO ATUAL Portal de Estudos em Química (PEQ) www.profpc.com.br Página 1 EXERCÍCIOS DE APLICAÇÃO 01 (CESGRANRIO-RJ) A distribuição eletrônica do átomo 56 26 Fe, em camadas é: a) 1s 2 2s 2 2p
Exercícios Sobre Atomística - Início dos modelos atômicos I
 Exercícios Sobre Atomística - Início dos modelos atômicos I 01. (Cftmg) O filme Homem de Ferro 2 retrata a jornada de Tony Stark para substituir o metal paládio, que faz parte do reator de seu peito, por
Exercícios Sobre Atomística - Início dos modelos atômicos I 01. (Cftmg) O filme Homem de Ferro 2 retrata a jornada de Tony Stark para substituir o metal paládio, que faz parte do reator de seu peito, por
Evolução do modelo atómico
 Os neutrões só foram descobertos em 1932 por Chadwick. Evolução do modelo atómico Demócrito (400 a.c.) Enunciou a primeira ideia de átomo como sendo a partícula elementar que constitui toda a matéria.
Os neutrões só foram descobertos em 1932 por Chadwick. Evolução do modelo atómico Demócrito (400 a.c.) Enunciou a primeira ideia de átomo como sendo a partícula elementar que constitui toda a matéria.
Correção da ficha de trabalho N.º3
 Correção da ficha de trabalho N.º3 1- Classifique as afirmações seguintes em verdadeiras ou falsas, corrigindo estas últimas: A. A passagem de um átomo de um estado excitado ao estado fundamental é acompanhada
Correção da ficha de trabalho N.º3 1- Classifique as afirmações seguintes em verdadeiras ou falsas, corrigindo estas últimas: A. A passagem de um átomo de um estado excitado ao estado fundamental é acompanhada
Química. Química 3 SUMÁRIO. e Pré-vestibular
 Química SUMÁRIO Química 1 MÓDULO 1 Estrutura da matéria - Atomística... 3 Estrutura da matéria: modelos atômicos, Z, A, isótopos e íons Estrutura da matéria: A eletrosfera MÓDULO 2 Classificação periódica
Química SUMÁRIO Química 1 MÓDULO 1 Estrutura da matéria - Atomística... 3 Estrutura da matéria: modelos atômicos, Z, A, isótopos e íons Estrutura da matéria: A eletrosfera MÓDULO 2 Classificação periódica
Átomo e Modelos Atô t m ô ic i o c s o
 Átomo e Modelos Atômicos Demócrito (Sec. V a.c.) defendeu a idéia de que a matéria era composta por pequeníssimas partículas. Átomo Demócrito (460 370 A.C.) Modelo baseado apenas na intuição e na lógica.
Átomo e Modelos Atômicos Demócrito (Sec. V a.c.) defendeu a idéia de que a matéria era composta por pequeníssimas partículas. Átomo Demócrito (460 370 A.C.) Modelo baseado apenas na intuição e na lógica.
Eletricidade Aula 1. Profª Heloise Assis Fazzolari
 Eletricidade Aula 1 Profª Heloise Assis Fazzolari História da Eletricidade Vídeo 2 A eletricidade estática foi descoberta em 600 A.C. com Tales de Mileto através de alguns materiais que eram atraídos entre
Eletricidade Aula 1 Profª Heloise Assis Fazzolari História da Eletricidade Vídeo 2 A eletricidade estática foi descoberta em 600 A.C. com Tales de Mileto através de alguns materiais que eram atraídos entre
A) a existência do oceano líquido é uma hipótese possível, pois um sal solúvel só forma uma mistura homogênea com a água, quando ela está líquida.
 TEXTO PARA A QUESTÃO 1. Sonda espacial detecta sal de cozinha em lua de Saturno A análise da composição química do anel mais externo de Saturno revelou a presença de 98% de água, 1% de cloreto de sódio,
TEXTO PARA A QUESTÃO 1. Sonda espacial detecta sal de cozinha em lua de Saturno A análise da composição química do anel mais externo de Saturno revelou a presença de 98% de água, 1% de cloreto de sódio,
Química A Intensivo V. 1
 Química A Intensivo V. 1 Exercícios 01)A A ideia apresentada na alternativa A, além de algo impossível, não estava incluída na teoria de Dalton que afirmava que átomos iguais pertenciam ao mesmo elemento
Química A Intensivo V. 1 Exercícios 01)A A ideia apresentada na alternativa A, além de algo impossível, não estava incluída na teoria de Dalton que afirmava que átomos iguais pertenciam ao mesmo elemento
Introdução à Eletricidade e Lei de Coulomb
 Introdução à Eletricidade e Lei de Coulomb Introdução à Eletricidade Eletricidade é uma palavra derivada do grego élektron, que significa âmbar. Resina vegetal fossilizada Ao ser atritado com um pedaço
Introdução à Eletricidade e Lei de Coulomb Introdução à Eletricidade Eletricidade é uma palavra derivada do grego élektron, que significa âmbar. Resina vegetal fossilizada Ao ser atritado com um pedaço
A ESTRUTURA ATÔMICA REPRESENTAÇÃO
 A ESTRUTURA ATÔMICA O modelo nuclear admite que o átomo é formado por uma região central extremamente pequena, o núcleo, em torno do qual giram diminutas partículas, constituindo uma outra região, a eletrosfera.
A ESTRUTURA ATÔMICA O modelo nuclear admite que o átomo é formado por uma região central extremamente pequena, o núcleo, em torno do qual giram diminutas partículas, constituindo uma outra região, a eletrosfera.
Lista de Exercício de Química - N o 6
 Lista de Exercício de Química - N o 6 Profa. Marcia Margarete Meier 1) Arranje em ordem crescente de energia, os seguintes tipos de fótons de radiação eletromagnética: raios X, luz visível, radiação ultravioleta,
Lista de Exercício de Química - N o 6 Profa. Marcia Margarete Meier 1) Arranje em ordem crescente de energia, os seguintes tipos de fótons de radiação eletromagnética: raios X, luz visível, radiação ultravioleta,
Juliana Cerqueira de Paiva. Modelos Atômicos Aula 2
 Juliana Cerqueira de Paiva Modelos Atômicos Aula 2 2 Modelo Atômico de Thomson Joseph John Thomson (1856 1940) Por volta de 1897, realizou experimentos estudando descargas elétricas em tubos semelhantes
Juliana Cerqueira de Paiva Modelos Atômicos Aula 2 2 Modelo Atômico de Thomson Joseph John Thomson (1856 1940) Por volta de 1897, realizou experimentos estudando descargas elétricas em tubos semelhantes
Apostila de Química Geral
 Cursinho Vitoriano UNESP - Universidade Estadual Paulista "Júlio de Mesquita Filho" Câmpus de São José do Rio Preto Apostila de Química Geral Período noturno Ligações químicas interatômicas Vanessa R.
Cursinho Vitoriano UNESP - Universidade Estadual Paulista "Júlio de Mesquita Filho" Câmpus de São José do Rio Preto Apostila de Química Geral Período noturno Ligações químicas interatômicas Vanessa R.
RESUMO 1 MODELOS ATÔMICOS
 RESUMO 1 MODELOS ATÔMICOS A constituição da matéria é motivo de muita curiosidade entre os povos antigos. Filósofos buscam há tempos a constituição dos materiais. Resultado dessa curiosidade implicou na
RESUMO 1 MODELOS ATÔMICOS A constituição da matéria é motivo de muita curiosidade entre os povos antigos. Filósofos buscam há tempos a constituição dos materiais. Resultado dessa curiosidade implicou na
Química Orgânica I Profª Dra. Alceni Augusta Werle Profª Dra.Tânia M. Sacramento Melo
 Química Orgânica I Profª Dra. Alceni Augusta Werle Profª Dra.Tânia M. Sacramento Melo Ligação Química e Estudo do Átomo de Carbono Aula 1 1- INTRODUÇÃO Os átomos são formados por nêutrons, prótons e elétrons.
Química Orgânica I Profª Dra. Alceni Augusta Werle Profª Dra.Tânia M. Sacramento Melo Ligação Química e Estudo do Átomo de Carbono Aula 1 1- INTRODUÇÃO Os átomos são formados por nêutrons, prótons e elétrons.
ATIVIDADES EM QUÍMICA Recuperação paralela de conteúdos
 Nova Friburgo, de de 2014. Aluno (a): Gabarito Professor(a): ATIVIDADES EM QUÍMICA Recuperação paralela de conteúdos Nº: Turma:100 Assuntos: Estrutura atômica; Tabela Periódica; Propriedades periódicas;
Nova Friburgo, de de 2014. Aluno (a): Gabarito Professor(a): ATIVIDADES EM QUÍMICA Recuperação paralela de conteúdos Nº: Turma:100 Assuntos: Estrutura atômica; Tabela Periódica; Propriedades periódicas;
CLASSIFICAÇÃO PERIÓDICA DOS ELEMENTOS
 CLASSIFICAÇÃO PERIÓDICA DOS ELEMENTOS PARTE 1 01. A classificação periódica apresenta os elementos na: a) seqüência crescente de números de massa; b) ordem de reatividade química; c) seqüência crescente
CLASSIFICAÇÃO PERIÓDICA DOS ELEMENTOS PARTE 1 01. A classificação periódica apresenta os elementos na: a) seqüência crescente de números de massa; b) ordem de reatividade química; c) seqüência crescente
QUÍMICA QUESTÃO 41 QUESTÃO 42
 Processo Seletivo/UNIFAL- janeiro 2008-1ª Prova Comum TIPO 1 QUÍMICA QUESTÃO 41 Diferentes modelos foram propostos ao longo da história para explicar o mundo invisível da matéria. A respeito desses modelos
Processo Seletivo/UNIFAL- janeiro 2008-1ª Prova Comum TIPO 1 QUÍMICA QUESTÃO 41 Diferentes modelos foram propostos ao longo da história para explicar o mundo invisível da matéria. A respeito desses modelos
EXERCÍCIOS DE APROFUNDAMENTO
 Prof. Agamenon Roberto ATOMÍSTICA www.agamenonquimica.com 1 EXERCÍCIOS DE APROFUNDAMENTO 01) (PUC-MG) A teoria atômica de Dalton só não está claramente expressa em: a) A formação dos materiais dá-se através
Prof. Agamenon Roberto ATOMÍSTICA www.agamenonquimica.com 1 EXERCÍCIOS DE APROFUNDAMENTO 01) (PUC-MG) A teoria atômica de Dalton só não está claramente expressa em: a) A formação dos materiais dá-se através
São Mateus ES, Novembro de 1998 SUMÁRIO. I Introdução. II Desenvolvimento. 2.1 Leis da reações químicas. III Conclusão.
 São Mateus ES, Novembro de 1998 SUMÁRIO I Introdução II Desenvolvimento 2.1 Leis da reações químicas III Conclusão IV Bibliografia I Introdução Tentar-se-à mostrar nesta obra uma pesquisa sobre a Lei das
São Mateus ES, Novembro de 1998 SUMÁRIO I Introdução II Desenvolvimento 2.1 Leis da reações químicas III Conclusão IV Bibliografia I Introdução Tentar-se-à mostrar nesta obra uma pesquisa sobre a Lei das
COLÉGIO NOSSA SENHORA DA PIEDADE. Programa de Recuperação Paralela. 2ª Etapa 2014. 1ª série Turma: FG
 COLÉGIO NOSSA SENHORA DA PIEDADE Programa de Recuperação Paralela 2ª Etapa 2014 Disciplina: QUÍMICA Professora: Maria Luiza 1ª série Turma: FG Caro aluno, você está recebendo o conteúdo de recuperação.
COLÉGIO NOSSA SENHORA DA PIEDADE Programa de Recuperação Paralela 2ª Etapa 2014 Disciplina: QUÍMICA Professora: Maria Luiza 1ª série Turma: FG Caro aluno, você está recebendo o conteúdo de recuperação.
Questão 01) Os átomos isótopos 2x+6 X 54 e 3x-4 Y 56 têm número atômico: a) 26. b) 27. c) 28. d) 54. e) 56. Gab: A. Questão 02)
 Questão 01) Os átomos isótopos 2x+6 X 54 e 3x-4 Y 56 têm número atômico: a) 26 b) 27 c) 28 d) 54 e) 56 Gab: A Questão 02) Uma certa variedade atômica do estrôncio, cujo número atômico é 38, tem número
Questão 01) Os átomos isótopos 2x+6 X 54 e 3x-4 Y 56 têm número atômico: a) 26 b) 27 c) 28 d) 54 e) 56 Gab: A Questão 02) Uma certa variedade atômica do estrôncio, cujo número atômico é 38, tem número
TD nº 02 Química 2 1º ano - 2011
 Prof. Willame TD nº 02 Química 2 1º ano - 2011 TABELA PERIÓDICA 1. A organização dos elementos Com a descoberta de uma grande variedade de átomos, tornou-se necessária à criação de uma sistemática de classificação.
Prof. Willame TD nº 02 Química 2 1º ano - 2011 TABELA PERIÓDICA 1. A organização dos elementos Com a descoberta de uma grande variedade de átomos, tornou-se necessária à criação de uma sistemática de classificação.
3.2. ORBITAIS E NÚMEROS QUÂNTICOS 3.3. CONFIGURAÇÕES ELETRÔNICAS. Aline Lamenha
 3.2. ORBITAIS E NÚMEROS QUÂNTICOS 3.3. CONFIGURAÇÕES ELETRÔNICAS Aline Lamenha OBJETIVOS Referir os contributos de vários cientistas e das suas propostas de modelo atómico, para a criação do modelo atómico
3.2. ORBITAIS E NÚMEROS QUÂNTICOS 3.3. CONFIGURAÇÕES ELETRÔNICAS Aline Lamenha OBJETIVOS Referir os contributos de vários cientistas e das suas propostas de modelo atómico, para a criação do modelo atómico
Lista de exercícios 04 Modelos atômicos incluindo Böhr - Revisão
 Lista de exercícios 04 Modelos atômicos incluindo Böhr - Revisão Observação teórica - Os postulados de Böhr A partir das suas descobertas científicas, Niels Böhr propôs cinco postulados: 1 o.) Um átomo
Lista de exercícios 04 Modelos atômicos incluindo Böhr - Revisão Observação teórica - Os postulados de Böhr A partir das suas descobertas científicas, Niels Böhr propôs cinco postulados: 1 o.) Um átomo
c) A corrente induzida na bobina imediatamente após a chave S ser fechada terá o mesmo sentido da corrente no circuito? Justifique sua resposta.
 Questão 1 Um estudante de física, com o intuito de testar algumas teorias sobre circuitos e indução eletromagnética, montou o circuito elétrico indicado na figura ao lado. O circuito é composto de quatro
Questão 1 Um estudante de física, com o intuito de testar algumas teorias sobre circuitos e indução eletromagnética, montou o circuito elétrico indicado na figura ao lado. O circuito é composto de quatro
Recursos para Estudo / Atividades
 COLÉGIO NOSSA SENHORA DA PIEDADE Programa de Recuperação Final Disciplina: Química Ano: 2012 Professor (a): Elisa Landim Turma: 1º FG Caro aluno, você está recebendo o conteúdo de recuperação. Faça a lista
COLÉGIO NOSSA SENHORA DA PIEDADE Programa de Recuperação Final Disciplina: Química Ano: 2012 Professor (a): Elisa Landim Turma: 1º FG Caro aluno, você está recebendo o conteúdo de recuperação. Faça a lista
REVISÃO PARA VESTIBULAR
 REVISÃO PARA VESTIBULAR MODELOS ATÔMICOS Desvendar os segredos da matéria, sua estrutura, sua constituição, sempre foi um desejo dos estudiosos. Cinco séculos antes de Cristo, os filósofos gregos especulavam
REVISÃO PARA VESTIBULAR MODELOS ATÔMICOS Desvendar os segredos da matéria, sua estrutura, sua constituição, sempre foi um desejo dos estudiosos. Cinco séculos antes de Cristo, os filósofos gregos especulavam
Ligações Químicas Ligação Iônica Ligação Metálica
 Química Geral e Inorgânica QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin Ligações Químicas Ligação Iônica Ligação Metálica Periodicidade O átomo é visto como uma esfera, onde só as
Química Geral e Inorgânica QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin Ligações Químicas Ligação Iônica Ligação Metálica Periodicidade O átomo é visto como uma esfera, onde só as
Resoluções das atividades
 Resoluções das atividades Sumário Aula 1 Evolução dos modelos atômicos: da alquimia ao modelo atômico de Thomson... 1 Aula 2 Evolução dos modelos atômicos: de Rutherford ao modelo atômico de Sommerfeld...
Resoluções das atividades Sumário Aula 1 Evolução dos modelos atômicos: da alquimia ao modelo atômico de Thomson... 1 Aula 2 Evolução dos modelos atômicos: de Rutherford ao modelo atômico de Sommerfeld...
Átomo e Modelos Atómicos
 Átomo e Modelos Atómicos Demócrito (Sec. V a.c.) defendeu a ideia de que a matéria era composta por pequeníssimas partículas. Átomo Demócrito (460 370 A.C.) Modelo baseado apenas na intuição e na lógica.
Átomo e Modelos Atómicos Demócrito (Sec. V a.c.) defendeu a ideia de que a matéria era composta por pequeníssimas partículas. Átomo Demócrito (460 370 A.C.) Modelo baseado apenas na intuição e na lógica.
Atomística Estrutura do Átomo
 Atomística Estrutura do Átomo 1. (Udesc 2014) O enunciado Em um mesmo átomo, não podem existir dois elétrons com o mesmo conjunto de números quânticos refere-se a(ao): a) Princípio da Exclusão de Pauli.
Atomística Estrutura do Átomo 1. (Udesc 2014) O enunciado Em um mesmo átomo, não podem existir dois elétrons com o mesmo conjunto de números quânticos refere-se a(ao): a) Princípio da Exclusão de Pauli.
História da Química: Empédocles (Séc. V a.c.)
 Prof.: Manzi História da Química: Empédocles (Séc. V a.c.) Teoria sobre os 4 elementos: Terra, Fogo, água e ar Aristóteles ( 350 a.c.) Quando a matéria recebe a forma ela se organiza nos quatro elementos
Prof.: Manzi História da Química: Empédocles (Séc. V a.c.) Teoria sobre os 4 elementos: Terra, Fogo, água e ar Aristóteles ( 350 a.c.) Quando a matéria recebe a forma ela se organiza nos quatro elementos
Qualidade Ambiental Química
 Qualidade Ambiental Química Programa Revisão dos Conceitos Básicos de Química e Estatística Poluição o Ar e a Química da Troposfera Reações Químicas ligadas à Emissão de Poluentes da Atmosfera Bibliografia
Qualidade Ambiental Química Programa Revisão dos Conceitos Básicos de Química e Estatística Poluição o Ar e a Química da Troposfera Reações Químicas ligadas à Emissão de Poluentes da Atmosfera Bibliografia
APSA 2 - Tabela Periódica 10º Ano Novembro de 2011
 1. Dada a distribuição eletrónica dos elementos a seguir, indique qual deles apresenta maior e menor raio atómico 3Li: 1s 2 2s 1 7N: 1s 2 2s 2 2p 3 9F: 1s 2 2s 2 2p 5 R: Maior raio Atómico = Li Menor raio
1. Dada a distribuição eletrónica dos elementos a seguir, indique qual deles apresenta maior e menor raio atómico 3Li: 1s 2 2s 1 7N: 1s 2 2s 2 2p 3 9F: 1s 2 2s 2 2p 5 R: Maior raio Atómico = Li Menor raio
a) Qual a configuração eletrônica do cátion do alumínio isoeletrônico ao gás nobre neônio?
 Questão 1: O Brasil é o campeão mundial da reciclagem de alumínio, colaborando com a preservação do meio ambiente. Por outro lado, a obtenção industrial do alumínio sempre foi um processo caro, consumindo
Questão 1: O Brasil é o campeão mundial da reciclagem de alumínio, colaborando com a preservação do meio ambiente. Por outro lado, a obtenção industrial do alumínio sempre foi um processo caro, consumindo
SIMULADO DE QUÍMICA. 1) Para eliminar a poeira e outras impurezas sólidas do ar, muitos aparelhos de purificação usam método da:
 SIMULADO DE QUÍMICA 1) Para eliminar a poeira e outras impurezas sólidas do ar, muitos aparelhos de purificação usam método da: a) ( ) filtração; b) ( ) flotação; c) ( ) separação de mistura; d) ( ) ventilação.
SIMULADO DE QUÍMICA 1) Para eliminar a poeira e outras impurezas sólidas do ar, muitos aparelhos de purificação usam método da: a) ( ) filtração; b) ( ) flotação; c) ( ) separação de mistura; d) ( ) ventilação.
Química. Resolução das atividades complementares. Q42 Ligação metálica
 Resolução das atividades complementares 3 Química Q42 Ligação metálica p. 59 1 (Cefet-PR) Analise as afirmações a seguir: I. O metal X é leve, sofre pouca corrosão e é bastante utilizado na construção
Resolução das atividades complementares 3 Química Q42 Ligação metálica p. 59 1 (Cefet-PR) Analise as afirmações a seguir: I. O metal X é leve, sofre pouca corrosão e é bastante utilizado na construção
PROF: Alex LISTA 1 DATA: 27/02/2011 Lista de Atomística (Vários vestibulares)
 NOME: PROF: Alex LISTA 1 DATA: 27/02/2011 Lista de Atomística (Vários vestibulares) ATOMÍSTICA 1. (Pucmg 2007) Assinale a afirmativa que descreve ADEQUADAMENTE a teoria atômica de Dalton. Toda matéria
NOME: PROF: Alex LISTA 1 DATA: 27/02/2011 Lista de Atomística (Vários vestibulares) ATOMÍSTICA 1. (Pucmg 2007) Assinale a afirmativa que descreve ADEQUADAMENTE a teoria atômica de Dalton. Toda matéria
01) (ACAFE) O grupo de átomos que é encontrado na forma monoatômica pelo fato de serem estáveis é:
 01) (ACAFE) O grupo de átomos que é encontrado na forma monoatômica pelo fato de serem estáveis é: a) Halogênios b) Calcogênios c) Metais Alcalinos Terrosos d) Metais Alcalinos e) Gases Nobres 02) (UFF-RJ)
01) (ACAFE) O grupo de átomos que é encontrado na forma monoatômica pelo fato de serem estáveis é: a) Halogênios b) Calcogênios c) Metais Alcalinos Terrosos d) Metais Alcalinos e) Gases Nobres 02) (UFF-RJ)
INTERAÇÃO DOS RAIOS-X COM A MATÉRIA
 INTERAÇÃO DOS RAIOS-X COM A MATÉRIA RAIOS-X + MATÉRIA CONSEQUÊNCIAS BIOLÓGICAS EFEITOS DAZS RADIAÇÕES NA H2O A molécula da água é a mais abundante em um organismo biológico, a água participa praticamente
INTERAÇÃO DOS RAIOS-X COM A MATÉRIA RAIOS-X + MATÉRIA CONSEQUÊNCIAS BIOLÓGICAS EFEITOS DAZS RADIAÇÕES NA H2O A molécula da água é a mais abundante em um organismo biológico, a água participa praticamente
Além do Modelo de Bohr
 Além do Modelo de Bor Como conseqüência do princípio de incerteza de Heisenberg, o conceito de órbita não pode ser mantido numa descrição quântica do átomo. O que podemos calcular é apenas a probabilidade
Além do Modelo de Bor Como conseqüência do princípio de incerteza de Heisenberg, o conceito de órbita não pode ser mantido numa descrição quântica do átomo. O que podemos calcular é apenas a probabilidade
APOSTILA DE QUÍMICA 2º BIMESTRE
 Nome: nº: Bimestre: 2º Ano/série: 9º ano Ensino: Fundamental Componente Curricular: Química Professor: Ricardo Honda Data: / / APOSTILA DE QUÍMICA 2º BIMESTRE TEORIA 1 EVOLUÇÃO DOS MODELOS ATÔMICOS 1.
Nome: nº: Bimestre: 2º Ano/série: 9º ano Ensino: Fundamental Componente Curricular: Química Professor: Ricardo Honda Data: / / APOSTILA DE QUÍMICA 2º BIMESTRE TEORIA 1 EVOLUÇÃO DOS MODELOS ATÔMICOS 1.
AULA 02: TABELA PERIÓDICA
 AULA 02: TABELA PERIÓDICA 1. INTRODUÇÃO A Tabela Periódica é, efetivamente, um instrumento organizador de conhecimentos sobre os elementos químicos, onde estes estão ordenados por ordem crescente de número
AULA 02: TABELA PERIÓDICA 1. INTRODUÇÃO A Tabela Periódica é, efetivamente, um instrumento organizador de conhecimentos sobre os elementos químicos, onde estes estão ordenados por ordem crescente de número
Elementos do bloco p
 Elementos do bloco p Características gerais principais Estados de oxidação e tipos de ligações Inicialmente, para efeitos didáticos, serão utilizados os elementos do grupo 13 (B, Al, Ga, In Tl), que apresentam
Elementos do bloco p Características gerais principais Estados de oxidação e tipos de ligações Inicialmente, para efeitos didáticos, serão utilizados os elementos do grupo 13 (B, Al, Ga, In Tl), que apresentam
Quando esses temas são compreendidos, o aprendizado da química orgânica se torna muito mais fácil, diminuindo a necessidade de memorização.
 REAÇÕES ORGÂNIAS A primeira vista, a química orgânica pode ser observada como uma coleção confusa de milhões de compostos, dezenas de grupos funcionais e um número infinito de reações químicas. Ao estudá-la,
REAÇÕES ORGÂNIAS A primeira vista, a química orgânica pode ser observada como uma coleção confusa de milhões de compostos, dezenas de grupos funcionais e um número infinito de reações químicas. Ao estudá-la,
Use protetor solar! ( )Terr ( )Satur ( )Marte. Volume 1 Módulo 2 Química Unidade 14. Para início de conversa...
 Volume 1 Módulo 2 Química Unidade 14 Use protetor solar! Para início de conversa... Quando Rutherford formulou o seu modelo atômico, conforme você estudou na unidade anterior, não levou em consideração
Volume 1 Módulo 2 Química Unidade 14 Use protetor solar! Para início de conversa... Quando Rutherford formulou o seu modelo atômico, conforme você estudou na unidade anterior, não levou em consideração
Lista de Exercícios de Recuperação do 3 Bimestre
 Lista de Exercícios de Recuperação do 3 Bimestre Instruções gerais: Resolver os exercícios à caneta e em folha de papel almaço ou monobloco (folha de fichário). Copiar os enunciados das questões. Entregar
Lista de Exercícios de Recuperação do 3 Bimestre Instruções gerais: Resolver os exercícios à caneta e em folha de papel almaço ou monobloco (folha de fichário). Copiar os enunciados das questões. Entregar
QUÍMICA POR QUE ESTUDAR QUÍMICA?
 QUÍMICA POR QUE ESTUDAR QUÍMICA? A Química contribui para a melhora da qualidade de vida das pessoas, se souber usá-la corretamente. Nosso futuro depende de como vamos usar o conhecimento Químico. A química
QUÍMICA POR QUE ESTUDAR QUÍMICA? A Química contribui para a melhora da qualidade de vida das pessoas, se souber usá-la corretamente. Nosso futuro depende de como vamos usar o conhecimento Químico. A química
ESTADOS DA MATÉRIA. O átomo é composto por outras partículas ainda menores.
 ESTADOS DA MATÉRIA A matéria que temos a nossa volta é formada de moléculas que são constituídas por átomos. Uma combinação destes átomos forma as substâncias que conhecemos, porém, devemos salientar que
ESTADOS DA MATÉRIA A matéria que temos a nossa volta é formada de moléculas que são constituídas por átomos. Uma combinação destes átomos forma as substâncias que conhecemos, porém, devemos salientar que
Projeto Embuá Unidade de Aprendizagem: ENERGIA
 Projeto Embuá Unidade de Aprendizagem: ENERGIA Energia para realizar reações químicas: eletrólise do iodeto de potássio aquoso Existem reações químicas não espontâneas, mas que são realizadas com rapidez
Projeto Embuá Unidade de Aprendizagem: ENERGIA Energia para realizar reações químicas: eletrólise do iodeto de potássio aquoso Existem reações químicas não espontâneas, mas que são realizadas com rapidez
Tabela periódica e propriedades periódicas
 Tabela periódica e propriedades periódicas Mendeleev Vários cientistas procuravam agrupar os átomos de acordo com algum tipo de semelhança, mas o químico russo Dmitri Ivanovich Mendeleev foi o primeiro
Tabela periódica e propriedades periódicas Mendeleev Vários cientistas procuravam agrupar os átomos de acordo com algum tipo de semelhança, mas o químico russo Dmitri Ivanovich Mendeleev foi o primeiro
Escola Secundária Anselmo de Andrade Teste Sumativo de Ciências Físico - Químicas 9º Ano Ano Lectivo 08/09
 Escola Secundária Anselmo de Andrade Teste Sumativo de Ciências Físico - Químicas 9º Ano Ano Lectivo 08/09 1ºTeste Sumativo 1ºPeríodo Duração do Teste: 90 minutos Data: 07 / 11 / 08 Prof. Dulce Godinho
Escola Secundária Anselmo de Andrade Teste Sumativo de Ciências Físico - Químicas 9º Ano Ano Lectivo 08/09 1ºTeste Sumativo 1ºPeríodo Duração do Teste: 90 minutos Data: 07 / 11 / 08 Prof. Dulce Godinho
RESOLUÇÃO COMENTADA DA PROVA DA UNESP DE 2014
 RESOLUÇÃO COMENTADA DA PROVA DA UNESP DE 2014 1-Alguns historiadores da Ciência atribuem ao filósofo pré-socrático Empédocles a Teoria dos Quatro Elementos. Segundo essa teoria, a constituição de tudo
RESOLUÇÃO COMENTADA DA PROVA DA UNESP DE 2014 1-Alguns historiadores da Ciência atribuem ao filósofo pré-socrático Empédocles a Teoria dos Quatro Elementos. Segundo essa teoria, a constituição de tudo
Leis Ponderais e Cálculo Estequiométrico
 Leis Ponderais e Cálculo Estequiométrico 1. (UFF 2009) Desde a Antiguidade, diversos povos obtiveram metais, vidro, tecidos, bebidas alcoólicas, sabões, perfumes, ligas metálicas, descobriram elementos
Leis Ponderais e Cálculo Estequiométrico 1. (UFF 2009) Desde a Antiguidade, diversos povos obtiveram metais, vidro, tecidos, bebidas alcoólicas, sabões, perfumes, ligas metálicas, descobriram elementos
Módulo: Tabela Periódica Atividade: Estudo da Tabela Periódica e Distribuição Eletrônica de Linus Pauling
 Guia do Professor Módulo: Tabela Periódica Atividade: Estudo da Tabela Periódica e Distribuição Eletrônica de Linus Pauling I Introdução A atividade Distribuição Eletrônica favorece o desenvolvimento de
Guia do Professor Módulo: Tabela Periódica Atividade: Estudo da Tabela Periódica e Distribuição Eletrônica de Linus Pauling I Introdução A atividade Distribuição Eletrônica favorece o desenvolvimento de
Química 1ª série Ensino Médio v. 1. Gabarito comentado
 Química 1ª série Ensino Médio v. 1 Exercícios Gabarito comentado Neste material você encontrará, além das respostas das atividades propostas no material didático Energia, resoluções completas com comentários
Química 1ª série Ensino Médio v. 1 Exercícios Gabarito comentado Neste material você encontrará, além das respostas das atividades propostas no material didático Energia, resoluções completas com comentários
Aluno(a): Instituição de Ensino: Município: Coordenador da Instituição de Ensino: ATENÇÃO: O DESENVOLVIMENTO TEÓRICO DAS QUESTÕES É OBRIGATÓRIO
 IX Olimpíada Capixaba de Química 2011 Prova do Grupo I 1 a série do ensino médio Fase 01 Aluno(a): Instituição de Ensino: Município: Coordenador da Instituição de Ensino: ATENÇÃO: O DESENVOLVIMENTO TEÓRICO
IX Olimpíada Capixaba de Química 2011 Prova do Grupo I 1 a série do ensino médio Fase 01 Aluno(a): Instituição de Ensino: Município: Coordenador da Instituição de Ensino: ATENÇÃO: O DESENVOLVIMENTO TEÓRICO
-2014- CONTEÚDO SEPARADO POR TRIMESTRE E POR AVALIAÇÃO CIÊNCIAS 9º ANO 1º TRIMESTRE
 -2014- CONTEÚDO SEPARADO POR TRIMESTRE E POR AVALIAÇÃO CIÊNCIAS 9º ANO 1º TRIMESTRE DISCURSIVA OBJETIVA QUÍMICA FÍSICA QUÍMICA FÍSICA Matéria e energia Propriedades da matéria Mudanças de estado físico
-2014- CONTEÚDO SEPARADO POR TRIMESTRE E POR AVALIAÇÃO CIÊNCIAS 9º ANO 1º TRIMESTRE DISCURSIVA OBJETIVA QUÍMICA FÍSICA QUÍMICA FÍSICA Matéria e energia Propriedades da matéria Mudanças de estado físico
Química. Resolução das atividades complementares. Q36 Classificação de elementos
 Resolução das atividades complementares 3 Química Q36 Classificação de elementos p. 24 1 (Fatec-SP) Imagine que a tabela periódica seja o mapa de um continente, e que os elementosquímicos constituem as
Resolução das atividades complementares 3 Química Q36 Classificação de elementos p. 24 1 (Fatec-SP) Imagine que a tabela periódica seja o mapa de um continente, e que os elementosquímicos constituem as
As cargas elétricas escoam do metal para o corpo humano e depois para o solo, pois todos são bons condutores --- R- C
 01-(UFPE-PE) Condutores são os materiais que permitem que as cargas (elétrons livres) se movimentem com facilidade no seu interior --- os metais, de uma maneira em geral, são bons condutores -- - assim,
01-(UFPE-PE) Condutores são os materiais que permitem que as cargas (elétrons livres) se movimentem com facilidade no seu interior --- os metais, de uma maneira em geral, são bons condutores -- - assim,
Água e Solução Tampão
 União de Ensino Superior de Campina Grande Faculdade de Campina Grande FAC-CG Curso de Fisioterapia Água e Solução Tampão Prof. Dra. Narlize Silva Lira Cavalcante Fevereiro /2015 Água A água é a substância
União de Ensino Superior de Campina Grande Faculdade de Campina Grande FAC-CG Curso de Fisioterapia Água e Solução Tampão Prof. Dra. Narlize Silva Lira Cavalcante Fevereiro /2015 Água A água é a substância
ESTRUTURA DOS MATERIAIS CERÂMICOS
 ESTRUTURA DOS MATERIAIS CERÂMICOS Os sólidos são caracterizados por uma associação muito próxima de átomos, em geral representados por esferas rígidas, em contato uns com os outros e mantidos juntos por
ESTRUTURA DOS MATERIAIS CERÂMICOS Os sólidos são caracterizados por uma associação muito próxima de átomos, em geral representados por esferas rígidas, em contato uns com os outros e mantidos juntos por
PROVA DE QUÍMICA - 1998 Segunda Etapa
 PROVA DE QUÍMICA - 1998 Segunda Etapa QUESTÃO 01 Num laboratório químico, havia três frascos que continham, respectivamente, um alcano, um álcool e um alqueno. Foram realizados experimentos que envolviam
PROVA DE QUÍMICA - 1998 Segunda Etapa QUESTÃO 01 Num laboratório químico, havia três frascos que continham, respectivamente, um alcano, um álcool e um alqueno. Foram realizados experimentos que envolviam
Lista 1 Atomística e tabela periódica
 Lista 1 Atomística e tabela periódica 1. (Ufrn 2013) A Lei Periódica e sua representação gráfica, a Tabela Periódica, são dois conhecimentos essenciais para a química e para os químicos. D. Mendeleev (1834-1907),
Lista 1 Atomística e tabela periódica 1. (Ufrn 2013) A Lei Periódica e sua representação gráfica, a Tabela Periódica, são dois conhecimentos essenciais para a química e para os químicos. D. Mendeleev (1834-1907),
Esse grupo já foi conhecido como gases raros e gases inertes.
 GASES NOBRES GRUPO 18 OU VIIIA Esse grupo já foi conhecido como gases raros e gases inertes. Gases raros não é apropriado porque o argônio (Ar) não é raro (é mais abundante que o CO 2 no ar). Gases Inertes
GASES NOBRES GRUPO 18 OU VIIIA Esse grupo já foi conhecido como gases raros e gases inertes. Gases raros não é apropriado porque o argônio (Ar) não é raro (é mais abundante que o CO 2 no ar). Gases Inertes
ESCOLA SECUNDÁRIA DE CASQUILHOS
 ESCOLA SECUNDÁRIA DE CASQUILHOS 1.º Teste sumativo de FQA 21. Out. 2015 Versão 1 10.º Ano Turma A e B Professora: Duração da prova: 90 minutos. Este teste é constituído por 9 páginas e termina na palavra
ESCOLA SECUNDÁRIA DE CASQUILHOS 1.º Teste sumativo de FQA 21. Out. 2015 Versão 1 10.º Ano Turma A e B Professora: Duração da prova: 90 minutos. Este teste é constituído por 9 páginas e termina na palavra
UNIDADE 3 - COORDENAÇÃO ATÔMICA
 A força de repulsão entre os elétrons de dois átomos, quando estão suficientemente próximos, é responsável, em conjunto com as forças de atração, pela posição de equilíbrio dos átomos na ligação química
A força de repulsão entre os elétrons de dois átomos, quando estão suficientemente próximos, é responsável, em conjunto com as forças de atração, pela posição de equilíbrio dos átomos na ligação química
Hoje estou elétrico!
 A U A UL LA Hoje estou elétrico! Ernesto, observado por Roberto, tinha acabado de construir um vetor com um pedaço de papel, um fio de meia, um canudo e um pedacinho de folha de alumínio. Enquanto testava
A U A UL LA Hoje estou elétrico! Ernesto, observado por Roberto, tinha acabado de construir um vetor com um pedaço de papel, um fio de meia, um canudo e um pedacinho de folha de alumínio. Enquanto testava
Configurações eletrônicas
 Configurações eletrônicas Metais de transição Depois de Ar, os orbitais d começam a ser preenchidos. Depois que os orbitais 3d estiverem preenchidos, os orbitais 4p começam a ser preenchidos. Metais de
Configurações eletrônicas Metais de transição Depois de Ar, os orbitais d começam a ser preenchidos. Depois que os orbitais 3d estiverem preenchidos, os orbitais 4p começam a ser preenchidos. Metais de
Exercícios de Eletrização
 Exercícios de Eletrização 1-Um corpo inicialmente neutro recebe 10 milhões de elétrons. Este corpo adquire uma carga de: (e = 1,6. 10 19 C). a) 1,6. 10 12 C b) 1,6. 10 12 C c) 16. 10 10 C d) 16. 10 7 C
Exercícios de Eletrização 1-Um corpo inicialmente neutro recebe 10 milhões de elétrons. Este corpo adquire uma carga de: (e = 1,6. 10 19 C). a) 1,6. 10 12 C b) 1,6. 10 12 C c) 16. 10 10 C d) 16. 10 7 C
grandeza do número de elétrons de condução que atravessam uma seção transversal do fio em segundos na forma, qual o valor de?
 Física 01. Um fio metálico e cilíndrico é percorrido por uma corrente elétrica constante de. Considere o módulo da carga do elétron igual a. Expressando a ordem de grandeza do número de elétrons de condução
Física 01. Um fio metálico e cilíndrico é percorrido por uma corrente elétrica constante de. Considere o módulo da carga do elétron igual a. Expressando a ordem de grandeza do número de elétrons de condução
Aula 2: O estudo da matéria
 KROTON S.A. UNIC EDUCACIONAL LTDA. ENGENHARIA DE PRODUÇÃO 2015/1 Aula 2: O estudo da matéria A Matéria Conceitos; Tudo que tem massa e ocupa lugar no espaço. - O que é massa? - Como se afere a massa de
KROTON S.A. UNIC EDUCACIONAL LTDA. ENGENHARIA DE PRODUÇÃO 2015/1 Aula 2: O estudo da matéria A Matéria Conceitos; Tudo que tem massa e ocupa lugar no espaço. - O que é massa? - Como se afere a massa de
